2024年5月23日晚,Nature官网发布了北京大学化学与分子工程学院应用化学系刘志博团队题为“Covalent Targeted Radioligands Potentiate Radionuclide Therapy”的研究论文。
据了解,这是Nature杂志自1977年以来首次发表核素治疗相关的工作,也是近50年来首篇放射性核素治疗领域论文。
论文报道了一类核药物设计领域的颠覆性技术及优异的临床研究数据,有望改写相关疾病的临床诊疗指南。临床研究基于现代共价药物分子工程发展了一类新型药物形式,即靶向共价放射性药物(Covalent Targeted Radioligand, 下称CTR),并从分子、细胞、小鼠及患者层面验证了该平台技术的有效性,突破了成纤维细胞活化蛋白(FAP,为泛癌种靶点)靶向放射配体因肿瘤摄取、滞留不足导致疗效不佳的瓶颈。
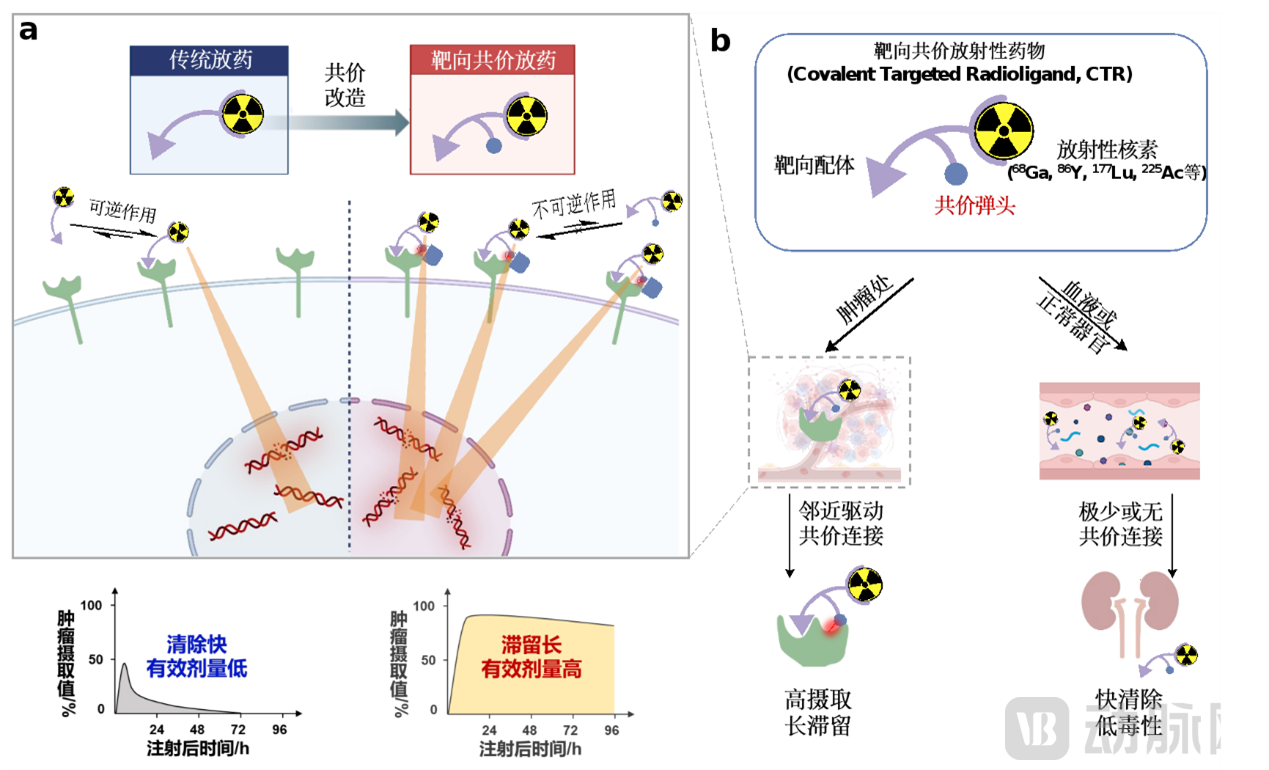
靶向共价放射性药物工作原理及其优势
刘志博为北京大学教授,博士生导师,国家杰出青年基金获得者,化学与分子工程学院应用化学系副主任,北大-清华生命联合中心中心研究员,昌平实验室领衔科学家。
针对放射性新药的研发瓶颈和我国医用核素、核药物长期依赖进口的现状,刘志博团队致力于放射性药物化学领域的应用基础研究,在核药物的构效关系、核药物驱动的活体化学及其健康效应等关键科学问题上取得了重要突破;以通讯作者身份在Nature, Nat Comm, ACS Cent Sci, JACS, Angew Chem等杂志发表论文30余篇。承担国家杰出青年基金、科技部重点研发计划(青年项目)等各类科研项目10余项。提出了“固体靶在线溶解”的医用核素制备新理念,立足自研设备实现了 Ac-225、Pb-212、Bi-213、Y-86 等紧缺医用核素的国内首次制备,研发了硼氨酸等多种放射性“1类新药”,并在临床试验中取得了成功。
此次论文中提到的靶向放射性核素治疗(Targeted Radionuclide Therapy,TRT)是应对癌症晚期转移病灶的一种变革性治疗方式,以肿瘤特异性高表达的分子为靶点,利用高亲和力特异性结合的配基(如抗体分子或多肽分子等)为载体,将强效的β或α放射性治疗核素(射程仅微米至毫米级)递送到肿瘤部位, 利用放射性核素的物理杀伤作用,进行分子级别的精准放疗。
值得一提的是,放射性核素靶向药物通过核射线不仅杀伤肿瘤组织表层或浅层的肿瘤细胞,还能利用核射线的穿透力杀伤实体瘤内部的肿瘤细胞,即“crossfire”效应。与单纯的生物药物和化学药物相比,放射性药物具有更强的杀伤力。另外,对于那些通过影像学诊断和外科手术都不能发现的小肿瘤病灶或转移灶,体内放射靶向治疗将发挥其独特的治疗功效。
为了优化靶向放射性核素治疗分子级别的精准放疗效果,以三大问题成为长期挑战:首先,让放射性核素精准地找到肿瘤细胞(通过配体-靶点结合),即优异的肿瘤靶向;其次,让放射性核素更长久地停留在肿瘤细胞处,以便让治疗放射性核素在有限的衰变时间内对肿瘤细胞进行充分杀伤;与此同时,还要保证正常器官中的放射性核素尽快地代谢排出,以减小治疗的副作用。
同时解决这三个方面的挑战困难重重,是进一步提升TRT疗效的关键。
而刘志博团队专研的CTR优势在于,它是一种高度选择性地将放射性配体固定到肿瘤的新型药物形式。该技术增强了放射性配体的肿瘤摄取和保留,并保证其在血液循环或健康组织的低摄取,有望攻克传统核药物安全性与有效性无法兼得的难题。
根据北京大学化学与分子工程学院官网介绍,CTR实现了三大技术突破:CTR实现对泛癌种靶点FAP的不可逆地选择性共价连接;CTR-FAPI展现更佳的PET成像对比度;CTR通过提高滞留增强靶向放射性核素治疗。
其中,对共价弹头的合理应用是CTR成功的关键因素之一。关于共价药物的一个普遍担忧是难以预知的脱靶毒性。由于放射配体普遍具有高亲水性且包含多电荷螯合剂,大多数放射配体对细胞膜的被动渗透性有限,因此CTR对胞内蛋白的脱靶作用可能不是问题。研究人员主要考察了CTR-FAPI对FAP同源膜蛋白的选择性,发现其仍能保持104倍的高度FAP选择性。此外,在小鼠血浆和患者尿液中,CTR-FAPI也显示出极低的脱靶反应性。
在PET成像对比度方面,基于一系列分子实验和细胞验证,研究人员分别在FAP高表达的细胞来源移植小鼠模型(Cell-derived xenograft,CDX)和患者来源移植小鼠模型(Patient-derived xenograft,PDX)中进一步验证,发现Ga-68标记的CTR-FAPI显示出比原始FAPI高2倍以上的肿瘤摄取,而健康组织中的摄取迅速清除。在一项初步的肿瘤成像临床研究中,这一策略比其他方法(包括传统FAPI-PET/CT)识别出了更多的甲状腺髓样癌病灶,说明CTR-FAPI有潜力成为下一代更高灵敏度的FAPI-PET探针。
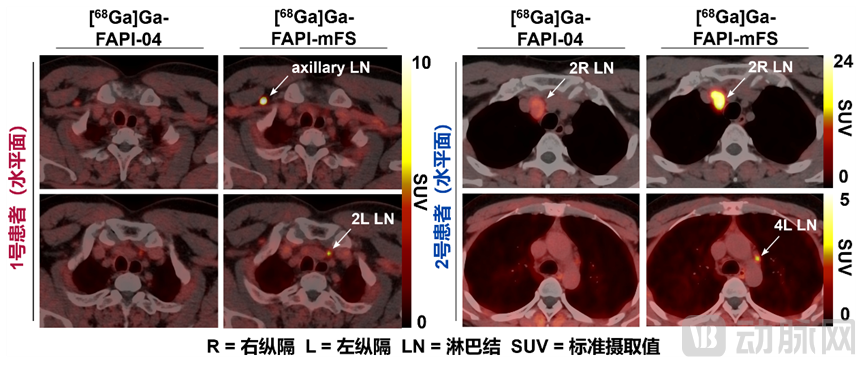
靶向共价放射性药物在癌症病人中灵敏度高,可以发现现有药物难以诊断的肿瘤病灶
需要指出的是,近年68Ga-FAPIPET/CT肿瘤显像(68Ga标记的成纤维细胞活化蛋白制剂分子探针PET/CT 显像)优势不断凸显,在实体瘤,如如乳腺癌、结肠癌和胰腺癌等,具有很强的促纤维增生应的特性,使得肿瘤相关的成纤维细胞和细胞外纤维化明显增多。
68Ga-FAPIPET/CT肿瘤显像中,肌肉、血池、肝脏及大脑本底低对检测微小原发病灶及转移灶判断与定位特异性及灵敏性高,尤其在与放化疗等治疗方式的选择提供决策参考;且68Ga-FAPI病灶的浓聚受局部炎症影响较小,可以准确定位肿的边界,可用于鉴别残余/复发性疾病和放化疗后纤维化,应用于生物靶区的勾画及疗效评估;与此同时,68Ga-FAPI具有非常低的非特异性肠/腹膜摄取,显示腹膜转移及胃肠胰的病变有优势。
在通过提高滞留增强靶向放射性核素治疗方面,研究者分别采用β-(Lu-177)和α-放射性治疗核素(Ac-225)标记CTR-FAPI(即FAPI-mFS),在后续治疗中几乎完全抑制了小鼠的FAP高表达皮下肿瘤生长。在另一种靶向前列腺特异性膜抗原(PSMA)的SuFEx工程化放射配体也显示出更强的治疗效果。由于可连接SuFEx弹头的蛋白质较为广泛,这一策略或可用于靶向其他靶点的放射性药物,并为调控其他低分子量偶联类药物的药代动力学提供了新途径。
根据沙利文数据,中国放射性显像诊断和治疗用药物市场规模已经从2017年的22亿元增至2021年的30亿元,并将在未来进一步增长,预计2030年市场规模将达到260亿元,2025年到2030年的复合年增长率将达到22.7%。而fortune business insights数据显示,全球核药市场预计从2023年的84亿美元增长至2030年的294亿美元。
从全球市场来看,核药发展较为快速。根据Pharmaprojects数据库,FDA批准上市的核药60余种,近10年来有近20种核药获批上市,其中9个核素偶联药物(RDC)中,就包括诺华两款重磅创新核药Lutathera(177Lu-dotatate,用于治疗生长抑素受体阳性的胃肠胰神经内分泌肿瘤)和Pluvicto(177Lu-PSMA-617,首个靶向前列腺特异性膜抗原的放射性药物)。
国内核医学起步较晚,并曾经历长时间的发展停滞,但近年来国家政策的支持和市场需求的增加促使这一领域迎来了新的发展机遇,但从研发到市场应用,显然还有很长的路要走。就目前国内的核药市场而言,临床使用的核药大部分为国外仿制药,自主原创性核药缺乏,近年来新上市的核药产品不多。这也意味着,本土企业想要建立自身竞争优势需要差异化布局。
国家八部委发布的《医用同位素中长期发展规划2021-2035年》明确指出:“我国放射性药物研制进展缓慢,自主原创性放射性药物缺乏。临床使用的放射性药物大部分为国外仿制药物。” 与此同时,诊断核药在临床上常与PET/CT 或 SPECT/CT设备结合使用,如果将设备看作“枪炮”,核药就是“子弹”,核医学发展一靠设备二靠药物,两者组合才能实现有效的核医学靶向诊断与治疗。为此,国家层面要求,加强放射性药物及核医学设备自主研发。
或许正是为了响应这一要求,也是为了加速填补市场和临床需求空白,国内核药赛道中,已有手握国内首个核医学1类创新药99mTc-3PRGD2的瑞迪奥签署商业化合作协议,将手中包括99mTc-3PRGD2在内、自主研发的一系列放射性药品及影像设备产品交由百洋医药在中国大陆地区做独家商业化运营权益。此外,百洋医药母公司百洋医药集团作为瑞迪奥的战略投资方,还与瑞迪奥携手进行了“药械合一”全产业链规划:除核药外,双方在核医学分子探针及高灵敏度核医学SPECT/CT研发制造领域联手展开布局。
现如今,刘志博团队报道靶向共价放射性药物的发布为国内核药技术的自主研发战队再添浓墨重彩的一笔,后续的商业化落地应用也值得期待。目前,国内核药行业已形成以东诚药业和中国同辐为核心的双龙头垄断局面,整体竞争格局较为稳定,但随着更多自研发环节就注重诊疗一体化和精准医疗的差异化新技术问世,未来的核药市场竞争格局有望迎来变革,走向多元化。
参考资料:
北大新突破!Nature刊发刘志博团队报道靶向共价放射性药物
昌平实验室官网




























