在人类蛋白质组的广阔领域中,有约85%的蛋白质属于“不可成药”或“难以成药”的靶点,因难以与小分子有效结合,一直是药物研发的难题。化学蛋白质组学的兴起,为这一挑战提供了系统的解决方案。
化学蛋白质组学,通过结合共价化学、蛋白质组学和质谱检测等方法,在活细胞中对小分子与蛋白靶点的结合进行综合研究和鉴定,为“难以成药”靶点的药物发现、药物的选择性、作用机制和致病机理等研究提供支持。全球范围内,化学蛋白质组学技术已转化为制药平台,应用于小分子药物的筛选与管线挖掘。
因此,化学蛋白质组学技术开辟出广阔的商业化前景,以其卓越的药物发现能力,在与制药行业巨头的合作中彰显潜力。2024年1月,BridGene Biosciences与Galapagos签订了一项总金额超过7亿美元的合作协议,BridGene将运用其前沿的IMTAC™平台,针对特定靶点发现新型小分子药物候选物。8月,双方进一步扩大了合作,将总金额提升至近9亿美元。此类合作不仅确保了BridGene的财务稳健,还借助合作伙伴的资源和专业经验,推动技术的持续创新。
同时,化学蛋白质组学平台公司也在积极构建临床研发管线——这标志着这一技术已正式迈入商业化阶段。以BridGene为例,依托其专有的IMTAC™平台,已经成功孵化并推进了多条独立的研发管线。其中,针对TEAD靶点的抑制剂项目已进入临床1期试验阶段。
进一步地,化学蛋白质组学平台技术公司也成为收并购市场和IPO的热点,展示出巨大商业化机遇。2021年,拜耳以20亿美金收购了Vividion Therapeutics,创下当时对临床前公司收购的最高预付款纪录。2024年3月,Frontier Medicines完成了超额认购的1亿美金的C轮融资。
在化学蛋白质组学商业化道路蓬勃发展之际,如何开发和搭建专有药物研发平台?应选择哪类小分子药物开发路径?又该如何引入研发迭代与商业化的“活水”?为了解答这些问题,动脉网采访了BridGene Biosciences(桥济生物)的联合创始人兼CEO曹平博士。

曹平博士:BridGene联合创始人、CEO,质谱专家,拥有超过20年蛋白质表征和蛋白质组学相关领域的研发经验,曾任安进(Amgen)蛋白质表征质谱分析团队负责人。
BridGene是一家专注于发现和开发创新小分子药物的生物技术公司。凭借其独家开发的化学蛋白质组学平台IMTAC™,BridGene能够在活细胞中对小分子与所有蛋白质的相互作用进行筛选,旨在快速发现并开发针对那些具有高价值但“难以成药”的靶点的潜在药物候选物。
人体蛋白质组包含超过20,000种蛋白质,其中约12,000种已被证实在人类疾病中起到作用,并有可能成为精准治疗的靶点。然而,2017年的一项统计显示,过去几十年中,美国FDA批准的1578个小分子药物和生物药仅涵盖了667个靶点。也就是说,大部分人体蛋白质组中的潜在药物靶点都没有相关药物。
创立BridGene之前,联合创始人曹平博士已在生物制药行业深耕近20年。作为质谱专家,曹平博士在安进公司工作了近14年,担任蛋白质表征质谱分析团队负责人。他回忆道:“在安进工作时,我的团队主要专注于新靶点的发现与管线支持工作,常常会听到科学家们抱怨,很多高价值的靶点都很难开发药物。从那时起,我就一直在构思,如何利用蛋白质组学技术,为‘难以成药’靶点开发药物。”
在曹平博士深耕质谱蛋白质组学技术的同时,BridGene的另一位联合创始人、南加州大学(University of Southern California)化学系和生物科学系张超教授正专注于化学遗传学、共价激酶抑制剂和化学蛋白质组学的研究。1998年,张超教授加入Kevan Shokat教授在普林斯顿的实验室攻读博士,参与并见证了Shokat实验室在蛋白激酶领域的奠基和开拓性工作。2003年,张超教授与Jack Taunton教授合作研发了RSK家族的共价激酶抑制剂及一个系统、高效的共价激酶抑制剂发现方法。从那时起,如何更高效地开发共价药物成为张超教授的研究重心之一。
2013年,Kevan Shokat教授在《Nature》杂志上首次报道了能够共价选择性结合KRASG12C突变半胱氨酸的分子,为“难以成药” 靶点中最为著名的KRAS靶点药物开发带来了新的希望。2017年初,与张超教授在化学蛋白质组学领域有过合作的Benjamin Cravatt教授依托化学蛋白质组学技术创办的Vividion Therapeutics获得了5000万美元A轮融资。这让张超教授意识到,属于化学蛋白质组学技术的时代已经到来。
于是,2018年,专注于共价药物开发和化学蛋白质组学应用的张超教授,前安进蛋白质组、质谱团队首席科学家曹平博士,以及具有丰富运营管理经验的Irene Yuan女士共同创立了BridGene Biosciences(桥济生物)。
在创立近六年以来,BridGene逐步建立起全球性的研发布局以及跨学科、全链条团队。2022年,公司成立了苏州桥济生物,集人才优势、速度优势、成本与运营优势,在中国和美国分别设立了研发中心。团队方面,BridGene拥有来自全球多个国家的科研成员,涵盖了工业端药物研发背景与学界科研背景。
集结多元创新要素,BridGene已建立起新一代化学蛋白质组学技术平台IMTAC™,致力于为整个蛋白质组中超过两万个蛋白找到共价小分子配体,并为高价值且难以成药的靶点开发小分子药物。
本质上讲,“难以成药”的现象凸显了现有药物发现策略的局限性。自21世纪以来,基于靶点的药物发现策略(Target-based Drug Discovery, TDD)已成为主流,这一策略依赖于研发者对特定靶点蛋白的深入理解。TDD策略通常涉及使用小分子库在体外环境中对单一纯化蛋白进行筛选,以寻找潜在的药物候选分子。
曹平博士指出,在以TDD为主流方法的这几十年里,FDA批准的新分子实体和新生物制剂数量均低于预期,而药物开发成本却在急剧增加,此外, 还出现了靶点扎堆和同质化严重的现象,这表明TDD策略急需调整以打破瓶颈。近年来,随着多组学技术和日益复杂的细胞模型的发展和应用,基于表型的药物发现(Phenotypic Drug Discovery, PDD)也正在迎来复兴。
化学蛋白质组学正是在这个节点中兴起,创造了全新的PDD+TDD的药物开发策略:由于化学蛋白质组学筛选能够与表型筛选一样在疾病相关的活细胞中进行,研究者可以先通过表型筛选来得到影响疾病表型的分子,随后通过化学蛋白质组学技术确定药物(通过表型筛选所得)在活细胞中所结合的蛋白及其结合强度,从而明确药物相对应的靶点、机理和开发方向,并快速开发与疾病强相关的药物。
在技术方面,BridGene建立了IMTAC™(Isobaric Mass Tagged Affinity Characterization)筛选平台,用共价小分子在活细胞里针对整个蛋白质组进行筛选,其主要由三部分组成:



第三部分是对与小分子结合的蛋白进行定性/定量质谱分析,分析小分子与蛋白的结合情况,定量化其相对结合力度强弱和选择性信息。
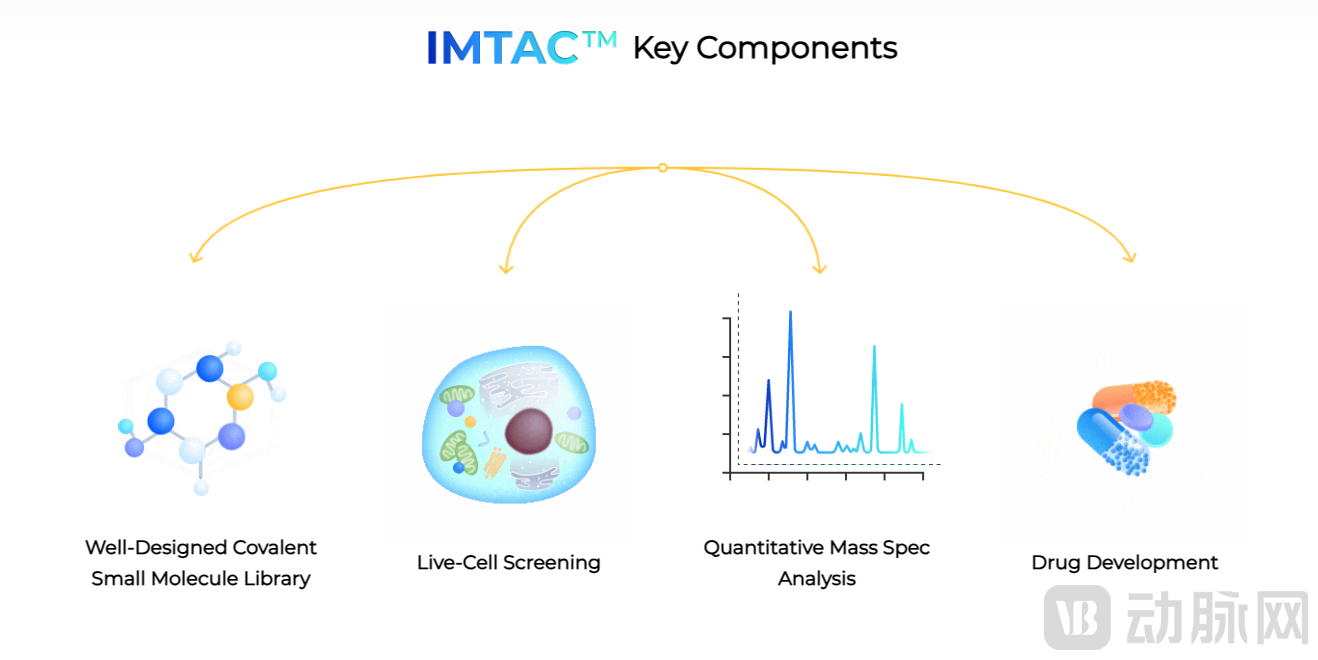
IMTAC™的关键组成部分(来源:BridGene官网)
BridGene的IMTAC™平台拥有四大独特优势:
高蛋白质组覆盖率
通过特有的共价分子库设计和直接竞争技术,IMTAC™可以对小分子与多种氨基酸的有效结合进行筛选,除了半胱氨酸外,还可以结合其他含亲核基团的氨基酸, 例如赖氨酸、 络氨酸等。
独特的筛选方法学
该方法可以降低背景噪音,提高对于结合蛋白定性、定量质谱分析的准确度。IMTAC™只分析与共价小分子相结合的蛋白,而将不与小分子结合的蛋白洗除掉,从而极大地降低背景噪音、提高结果的准确性和可重复性。其他技术如isoTOP-ABPP则是通过分析大量的背景噪音,并推导出竞争后缺失的位点,来判断哪个蛋白与小分子结合。
可筛选共价与非共价小分子
IMTAC™技术即可筛选共价小分子, 也可以筛选非共价小分子,极大地扩大了化学蛋白质组学的应用领域。
IMTAC™ 定向筛选技术
是BridGene目前最主要的合作技术之一,可为高价值难成药的靶点快速找到小分子配体,针对特定靶点(如表达量低,含基因突变的难成药靶点)进行定向筛选。相比全蛋白质组筛选,定向筛选有较高通量,可在短时间内获得小分子配体,快速推进后续研发。
因此,IMTAC™能够快速发现多类“难以成药”靶点的小分子配体,包括:





共价驱动的选择性:共价抑制剂可以针对并修改特定蛋白家族成员的独特半胱氨酸残基。
依托IMTAC™ 平台,BridGene已经发现了超过4000个蛋白的小分子配体,其中75%的蛋白在此之前没有已知的小分子配体。这些蛋白包含了转录因子、表观遗传调节因子、剪接因子、E3连接酶等传统上被认为“难以成药”的靶点,可以直接将其开发成影响蛋白活性的first-in-class的小分子抑制剂、异构调节剂或者与蛋白降解技术结合开发降解剂。
此前报道中,BridGene的联合创始人张超教授曾以港口和渔船来比喻共价药物与非共价药物的异同:非共价药物对目标靶点的作用,就像是一条船(非共价小分子)停泊在一个形状跟它比较契合的港口(靶点的蛋白口袋),这条船阻断了港口的交通,以此调控港口信号传导,进而控制疾病。非共价药物这条船一直是处于漂浮状态的,它可以进入港口,也能随时从港口出来。
共价药物则不同。这条船泊入蛋白口袋这个港口后,其共价弹头能与蛋白口袋周围的某个氨基酸形成共价键。就像在船头抛了一个船锚,让其无法离开港口。对于“难以成药”靶点,非共价药物很难“停泊”并发挥有效性。而共价药物则凭借特有的“船锚”共价键,留住共价分子,控制靶点信号传导。
共价药物是一类含有活性反应基团的药物,可以与靶蛋白形成共价键,从而赋予其额外的亲和力。因此,共价药物的长期靶向结合可提供独特的药效学特征和较高的生化效率。极具代表性的例子即为KRAS G12C突变位点,催生出多款靶向KRAS G12C的小分子共价抑制剂,包括已获批上市的安进Sotorasib、Mirati Adagrasib。
化学蛋白质组学则为共价药物的研发带来了新的理性开发策略。依托于IMTAC™平台,BridGene能够在活细胞环境下,针对整个蛋白组来系统性地开发安全有效的共价药物。IMTAC™可以对针对各种氨基酸的共价弹头(已知/创新),定量评估其在全蛋白质组范围内与各种蛋白之间的反应活性,并挑选出反应活性适中的共价弹头来设计共价分子,以最大化其成药性。
除了共价抑制剂外,BridGene还建立了共价蛋白降解剂(Covalent PROTAC)技术。依托IMTAC™平台,BridGene发现了超过4000个蛋白的小分子配体,其中有超过100个是E3连接酶。E3连接酶由于涉及蛋白间相互作用,缺乏良好的疏水性口袋,常被认为是“难以成药”的靶点。BridGene正在开发针对多个高价值靶点的共价降解剂。
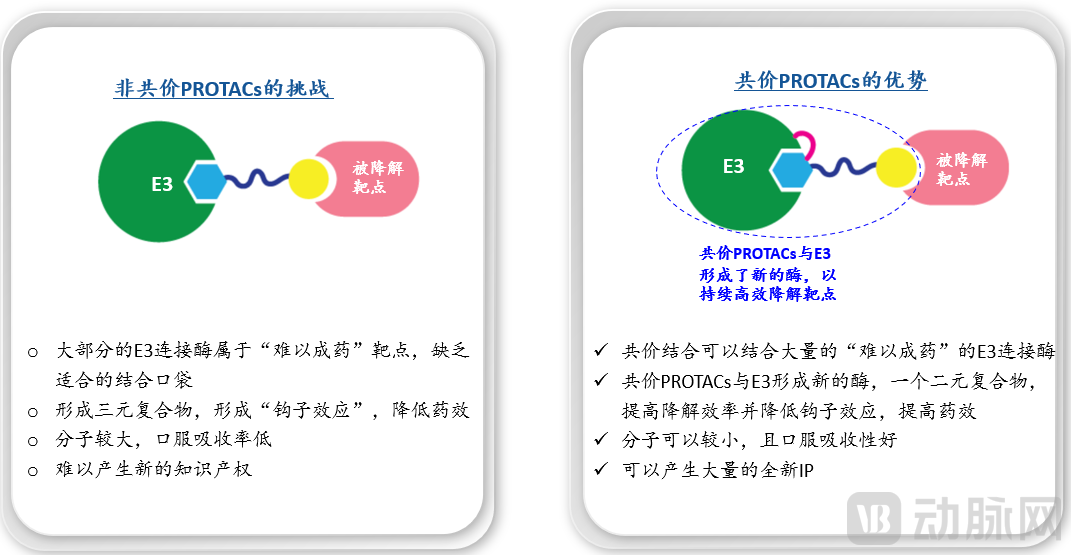 非共价与共价蛋白降解剂(PROTACs)
非共价与共价蛋白降解剂(PROTACs)
在接受采访时,曹平博士提及了合作伙伴Galapagos名称背后的深厚寓意:Galapagos群岛,作为启发达尔文提出自然选择理论的圣地,其名字已成为创新、适应性和科学进步的象征。这种探索精神与BridGene追求的开拓精神不谋而合。
曹平博士明确指出:“平台和项目合作是BridGene发展策略的核心之一。我们将依托独特的技术平台,与在制药领域拥有丰富经验、药物开发和商业化能力的合作伙伴携手推进项目。我们相信这种合作模式不仅能够加速药物候选物的开发与发现,拓宽我们专有技术应用领域,还将为我们带来显著的商业化收益。”
以与Galapagos的合作为例,BridGene将运用其IMTAC™平台,针对指定的肿瘤靶点,发掘新型小分子药物候选物。通过结合Galapagos在临床开发和资金方面的优势,双方将共同努力推动这些候选物成为临床阶段的药物。根据合作协议,Galapagos拥有这些药物的开发和商业化独家权利,而BridGene则有资格获得基于产品净销售额的分层版税。
与此同时,BridGene也在积极推进自己的研发管线,目前已开辟了7条在研管线。其中,针对TEAD蛋白(Hippo信号通路)的抑制剂已进入临床1期试验阶段,这为BridGene开发平台的有效性提供了有力的证明。
曹平博士补充说:“作为一家生物技术公司,我们将专注于少数几个独立的管线,但IMTAC™平台已经提供了一些极具潜力的靶点。展望未来,我们将继续寻求与大型制药公司进行许可转让或共同研发的机会。”事实上,BridGene此前已与武田制药两次达成合作,共同推进多个新药项目的研发。
全球范围内,Vividion、BridGene、Frontier等创新公司利用专有的化学蛋白质组学技术平台发现的药物,已成功进入临床阶段,预示着化学蛋白质组学在药物发现和商业化方面的巨大前景。正在进行的临床试验正逐步证实这一技术的效用和发展潜力。
化学蛋白质组学的广泛应用,不仅为解开人类蛋白质组的未知之谜提供了钥匙,也为药物发现、致病机理研究和成药性探索开辟了新的路径。这也预示着生物医药领域即将迎来的重要变革——许多曾被认为难以成药的靶点,如今得以转化为治疗手段,推动满足人类健康的巨大需求。





























