希格生科的成立,要追溯到创始人兼CEO张海生博士后时期的一段奇遇。就读于哈佛大学丹娜法伯癌症研究所期间,出于对创业转化的热情,张海生加入了麻省理工学院中国创新与创业论坛(MIT-CHIEF)。这一过程中,张海生积累了丰富的创业资源与经验。
一场感恩节前周末的MIT-CHIEF年会上,张海生邀请到美国三院院士、“人类基因组计划”领军人物、个人基因组学、基因编辑以及合成生物学领域鼻祖的George Church教授作为开幕式嘉宾进行分享。意料之外,George Church教授在当天并没有出现在年会现场,临时取消了报告分享。但张海生没有放弃,通过各种方式进行联系,终于在当天晚上收到了教授回复的歉意消息,表示自己的原因忘记参会,可以做任何事情(来弥补)。
于是,张海生再次邀请George Church教授作为闭幕式演讲嘉宾出席第二天的年会。George Church当天提前一小时到场,完成了精彩且圆满的分享。之后,张海生感谢Church教授让年会圆满,而Church教授也笑谈,感谢张海生让他弥补失误,没有辜负粉丝。年会结束后,在开车送教授回家的路上,张海生谈起了自己的创业计划。后来的故事是,George Church教授为希格生科的发展提出许多重要建议,目前仍担任希格生科的重要科学顾问。
2020年,张海生和其导师人类胃癌和食管癌基因组计划主席Adam Bass, M.D.教授在哈佛大学开始创业。同年12月,希格生科(深圳)有限公司落地深圳市河套深港科技创新合作区国际生物医药产业园,成为国内首家基于类器官疾病模型+AI的癌症创新靶向药研发公司。创立1年内,希格生科完成了3轮、共计1.5亿元天使轮融资。
应用接近病人基因组学特征的类器官疾病模型在药效评价及新靶点发现中的关键作用,结合AI人工智能筛选、合成和优化小分子化合物,希格生科致力于开发first-in-class创新靶向药,目前已有三条在研药物管线。2024年6月,希格生科首条管线获得FDA批准进入临床阶段,这也是全球首条进入临床的弥漫性胃癌靶向药管线。动脉网特别采访到希格生科创始人、CEO张海生博士。

张海生博士,哈佛大学Dana-Farber 癌症研究所(DFCI)博士后,MIT博德研究所Associate Researcher,现任希格生科(深圳)有限公司创始人兼CEO,兼任深圳清华大学研究院癌症靶向治疗研发中心主任。
在全球顶尖研究型医院——哈佛大学附属丹娜法伯癌症研究所期间,Adam Bass, M.D.教授与张海生主要深耕的方向是胃癌研究。胃癌(GC)是全球范围内较为常见的癌症之一,尤其在亚洲地区发病率较高。根据国际癌症研究机构(IARC)2020年统计数据,在中国,胃癌发病人数和死亡人数分别占全球的44%和48.6%。
张海生回忆,“早期在中科院读生物化学与分子生物学博士时,就有考虑在临床研发方向创业,赴美学习后也是在寻找差异化的创业机会——最终锁定了胃癌中的弥漫性胃癌分型。胃癌主要发病在亚洲和欧洲,特别是中国,在美国发病与研究都较少,科研突破上尚有余地。这种在美国属于罕见病种、在中国是大病种的恶性肿瘤,最终只能来靠我们自己人来攻克”。
弥漫性胃癌(diffuse gastric cancer, DGC)是一种高侵袭性肿瘤,来自Lauren分型(分为肠型胃癌和弥漫性胃癌)。相比发病率较高、预后较好的肠型胃癌,弥漫型胃癌呈弥漫性生长,具有高度侵袭性和低分化癌细胞的典型特征,易出现淋巴结转移和远处转移,预后较差。
在分子上,癌症基因组分析的一项大型分析将大多数DGC归入基因组稳定肿瘤的类别,因为它们缺乏超突变和明显的染色体不稳定性。药物端,曲妥珠单抗、德曲妥珠单抗、帕妥珠单抗、泽尼达妥单抗等多种肠型胃癌靶向药逐步进入全球市场,但弥漫性胃癌靶向治疗尚未出现有效的靶向药物。
通过建立基于患者基因组学的类器官模型、培养胃类器官原位注射模型,张海生团队首次重现了弥漫性胃癌患者疾病发生、癌细胞转移等的特点,并通过建模在全球范围内首次发现弥漫性胃癌全新靶标——FAK(Focal Adhesion Kinase,粘着斑激酶)。
创新靶标发现是药物发现的第一步。进一步地,希格生科创新类器官+AI(BT+AI)整体方案主要在创新药设计与筛选阶段发挥作用。
类器官,即干细胞或器官细胞体外3D培养,发生细胞定向分化,自组装为器官样结构,能模拟真实器官的结构和功能的细胞群。传统方案中,针对AI分子筛选结果将进行体外2D细胞系及体内移植瘤模型验证、优化,缺乏基于分子标志物的病人筛选,导致响应率难以预测。类器官构建的三维细胞图像更接近细胞真实形态,进而更适宜进行真实药物评价。
在药物发现与设计中,希格生科深度合作AI制药头部企业晶泰科技“基于深度神经网络的ADME/T预测及筛选”,设计并合成了一批具有强活性的候选分子。张海生介绍,“经过AI设计、优化与初筛,靶向创新靶点的化合物可以从几十万甚至百万个分子筛选出几十个分子。我们既推进传统药物研发方案的体外2D细胞系及体内移植瘤模型验证、优化,又在后续利用类器官疾病模型迅速推进药效评价。”
在药效评价中,希格生科利用其独有的基于类器官疾病模型的评价平台(筛选与优化),可以更好地筛选出接近病人真实反应的分子,以确保对于特定疾病靶点具有高度的活性和选择性,从而大大提高临床试验成功的潜在可能。
基于这一平台,希格生科还可以根据开发的伴随诊断分子标志物进行目标病人筛选,达成可预测的高响应率,把药物管线在临床阶段可能遇到的问题提前到临床阶段解决。
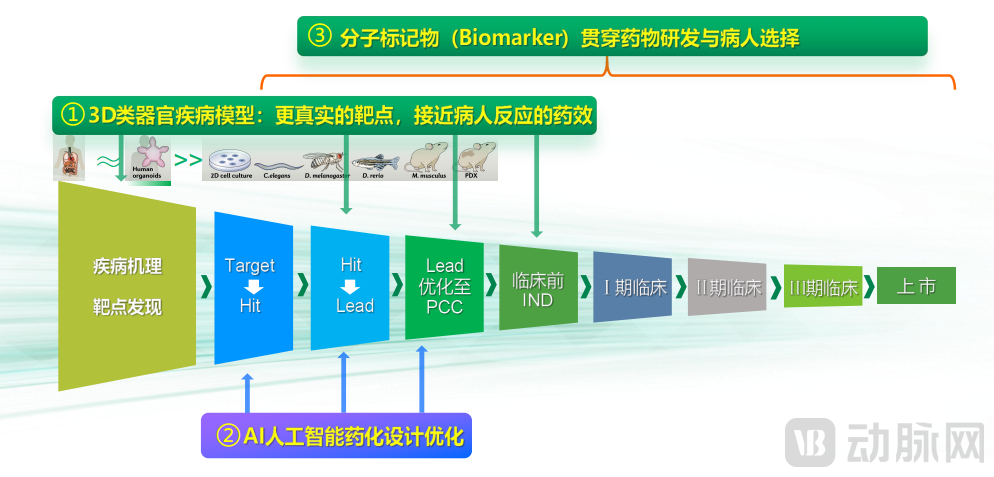
希格生科类器官+AI平台 3大角度赋能药物临床前研发
针对创新靶点FAK,希格生科与晶泰科技仅用6个多月便设计并优化了具有全新的分子结构、综合成药性质优越的候选化合物,后续依托独有的弥漫性胃癌类器官模型进行临床前药效评价。
总体来看,此次获批IND的药物管线也是全球首款整合类器官疾病模型+AI研发的1类创新靶向药。从新靶点发现到IND获批仅用时三年多,希格生科快速推进管线的关键即在于其基于类器官疾病模型+AI的药物研发模式。
在传统的新药研发模式中,从药物发现到获得IND监管批准的整个过程通常需要5—8年,并且伴随着高成本和高失败率。而希格生科基于类器官+AI的全新药物研发模式,通过筛选、评价与优化平台,利用类器官疾病模型及AI模式,以确保对于特定疾病靶点具有高度的活性和选择性,进而提升创新药在临床前阶段的效率和成功率。
另外,希格生科类器官+AI药物研发模式正在临床前数据、实验辅助证据探索标准创新,且通过类器官疾病模型更早地模拟人体环境,从而降低临床阶段失败风险,可能减少高达数十亿美元的研发成本。
除了弥漫性胃癌,临床前的药效也表征此款靶向药在卵巢癌,三阴性乳腺癌以及胰腺癌等恶性转移性癌症中具有优越的单药疗效,以及在与化疗或KRAS突变以及EGFR突变的靶向药联用中均展现出优越的治疗效果.随着临床研究的开展,有望在更多治疗领域发挥作用。
面对投资者和产业方,张海生总会碰见一个问题——做类器官+AI平台,希格生科究竟是做药的还是做平台服务的?他这样回答:“很久之前我认为做研究可能是为了发论文。走到创业一线的时候我发现,学术论文是真的可以转化成为进入临床试验的药物,去把研究转化为治病救人。所以,希格生科是一个创新靶向药研发公司。”基于类器官疾病模型的药效评价平台,则是希格生科团队在做药的过程中通过内部研发体系(in house)挖掘出来的高效应用模型。
“一款药,做10年,超过20亿,成功率小于5%”,无论对于创新药企还是大型药企,研发的巨大风险与巨额投入是创新药永恒的母命题。希格生科希望通过基于类器官疾病模型的评价平台,最大程度地桥接临床前模型与临床病人,由此为药企筛选管线提供一定的数据与模型支持。“我们管线进入IND、做临床的过程,也是侧面验证这一模型路径走得通的过程。”
2022年9月29日,FDA通过了现代化法案2.0,取消了对动物试验的强制要求;首个基于类器官获得的新药获批进入临床。这被视为类器官相关实验数据作为药物IND或后续研发证据的重要里程碑。同年,国内出台《类器官药敏检测指导肿瘤精准治疗临床应用专家共识》。直至今日,类器官应用于新药药效学验证、临床前及临床试验证据的相关探索仍处于多点开花的阶段。
或许来自长期扎根科研的严谨,张海生对于类器官模型的替代和数据佐证保持着一种审慎且乐观的态度,“我认为类器官对于实验动物的完全替代在短期内是不可能实现的。当下关键问题是如何让不断发展的类器官在新药研发过程或者其他领域实现切实的赋能。”
张海生举了一个例子:心脏安全性评价(检测化合物对hERG离子通道的影响)是各类新药进入临床试验前必须考察的一个重要的因素,也是创新药早期临床研究中极为重要、难度较高的环节之一。
“由于临床准确性不高,hERG指标对于后续临床的指导作用一直有所争议。我们团队对部分FDA批准上市的或者完成2期临床的药物去做hERG指标的盲测,发现这个系统模型与临床的关联度是有限的,准确率大概只有40%。而应用希格生科可跳动的心脏3D类器官模型,准确率可以提高到78%,进一步优化可以达到85%”。这一突破对于药物的临床前的心脏毒性,特别是非肿瘤药的临床前心脏毒性的筛选尤为重要,可以排除hERG产生的假阳性或者假阴性。
“脚踏实地才能走得更远”,张海生说,这个例子其实是提醒,在展望类器官应用远大理想的同时,我们应该考虑更多可落地的、可触及的小目标,比如替代、完善、辅助心脏安全性评价实验,药物肠道渗透性预测模型等等。
目前,希格生科类器官疾病模型+AI相结合的新药研发模式已实现小规模商业化,依托1200㎡研发场地和500㎡实验动物房,为药企筛选管线提供支持,持续加速药物的源头发现与临床转化。与此同时,希格生科首款管线正式迈入临床阶段,即将开展一期临床试验,并有多条储备管线处于临床前研发阶段。





























