2024年10月16日,专注于肿瘤和自免疾病通用型γδT细胞疗法的上市公司Adicet Bio(纳斯达克股票代码:ACET)宣布,FDA已同意对公司提交的IND申请进行修订,以评估公司旗下管线ADI-001在特发性炎症性肌病(IIM)和僵人综合征(SPS)的1期试验中的疗效。据悉,公司计划于2025年第一季度开始招募IIM和SPS患者。
近年来,细胞与基因治疗(Celular and GeneTherapy,下简称CGT)行业发展势头正盛,但由于CGT产品的复杂性与特异性,对其生产变更的管理带来了诸多挑战。CGT产品的生产和控制通常会受到许多独特因素的影响,包括对产品质量属性了解的有限性、生产经验的有限性、起始物料的有限性与多样性、有限的产品量、复杂的生产工艺、以及产品保质期的有限性。
对于新兴的biotech、尤其是注重商业化落地优势的通用型CAR-T疗法公司而言,要实现降本(最终商品价格)与增效(确保通用型CAR-T疗法临床效果与字体CAR-T疗法比肩),就需对产品进行生产变更,如改进产品质量、扩大产品供应或提高生产效率等原因,这无疑又增加了产品开发的难度。因此,2023年7月13日,FDA发布了《人类细胞与基因治疗产品的生产变更与可比性》指南草案,为CGT产品生产变更的管理和报告以及用于评估生产变更对产品质量影响的可比性研究提供了一些建议。该指南指出,如果先前提交的生产信息不再准确反映当前的生产状态,申请方需在IND阶段须通过修订通知FDA生产变更。
其中涉及到的生产变更,正是一众通用型CAR-T疗法新秀们力图攻克的痛点之一。
TCRL抗体升级自有资产
前文提到的Adicet Bio,在2016年Fierce Biotech公布的最具投资价值的生物技术公司中赫然在列,距其成立刚刚两年时间。为什么一个创立公司能获得如此关注?
这或许与其创立背景有关。Adicet Bio的创始人之一Aya Jakobovits正是美国Kite Pharma(凯德药业公司,2014年6月,只有19名员工的Kite Pharma公司在美国纳斯达克上市,市值曾一度达到17亿美元,下称Kite)的前任创始人兼CEO,也是奥博资本(OrbiMed)的现任合伙人。
在Kite成功IPO的2014年,Adicet Bio在收购以色列免疫疗法公司Applied Immune Technologies(下称AIT)后开业,后者是一家以抗体为基础的药物研发与目标选择公司,针对癌症、病毒及自我免疫疾病等提供治疗方案。Adicet Bio以开发新型通用型细胞免疫治疗方法治疗疾病为宗旨,公布了核心技术——T细胞受体样抗体技术(TCRL)和单克隆抗体技术。据悉,该类抗体可模仿人体T淋巴细胞在主要组织相容性复合体(MHC)中识别细胞内抗原。Adicet Bio也宣称,公司正在致力于开发第三代免疫疗法技术。
与此同时,Aya Jakobovits也为其进行了5100万美元的A轮募资。据她介绍,Adicet Bio与AIT有望进行良好的融合,后者专注于T细胞受体样抗体,而前者则是计划生产主要组织相容性复合体(MHC)的单克隆抗体,双方将联手从血液和实体瘤癌症患者炎症、自身免疫病患者的未满足临床需求出发。
AIT的核心资产成为了Adicet Bio扩展其他种类免疫治疗技术的关键。AIT专注研究的靶向细胞内派生多肽的T细胞受体样抗体(TCRL),可模仿人体T淋巴细胞在主要组织相容性复合体(MHC)中识别细胞内抗原。如此一来,人体内病变细胞被识别后可以被免疫系统快速消除,并阻止其恶化为癌症或自身免疫疾病。
此外,AIT专注 T细胞受体样抗体,也是对Adicet Bio的技术的一个补充。Aya Jakobovits认为,在T细胞的研究中最重要的,是保证免疫细胞能够特异性识别肿瘤细胞并清除它,避免伤及到正常组织,而AIT的技术恰好能保证Adicet Bio做到这一点。
Aya Jakobovits曾表示,为了获得肿瘤特异性靶点,必须要接触细胞内的靶点肽池——即被运输到细胞表面,并在细胞表面表达,与MHC分子结合的肽。AIT在生产能够特异性结合到细胞表面肽-MHC复合物的单克隆抗体的技术方面一直处于领先水平。此外,由于靶向肽-MHC复合物的技术不仅仅适用与癌症的治疗,这也能帮助Adicet Bio研发并优化针对自身免疫疾病的治疗技术。
TCRL平台对Adicet Bio后续的重要管线打下基础。该平台能够生成能够识别肿瘤细胞内肿瘤抗原的CARs,这些肿瘤抗原也称为细胞内蛋白质。这些细胞内蛋白被细胞处理并由主要组织相容性复合物(MHC)编码的抗原呈递分子所呈递。能够选择性地与特定来源于细胞内蛋白质的肿瘤抗原结合,是免疫细胞治疗的一个关键优势,因为在实体肿瘤上肿瘤特异性表面抗原的稀缺性。
Adicet Bio在2020年顺利上市。截至2024年10月24日,公司已募资近4亿美元。
核心杀手锏:γδT细胞平台
Adicet Bio在通用型细胞疗法上的真正杀手锏在2018年才正式亮相。彼时Adicet Bio经历了换帅,并首次在官方公告中明确,公司将专注于提供用嵌合抗原受体和嵌合衔接子设计的γδT细胞(gamma delta T cells,伽玛-德尔塔细胞),以增强选择性肿瘤靶向,促进先天性和适应性抗肿瘤免疫反应,并增强患者持久活性的持久性。
γδT细胞是执行固有免疫功能的T细胞,其TCR由γ和δ链组成。 γδT细胞是一种既能杀伤癌细胞,肿瘤干细胞,又能识别癌抗原的免疫细胞。
构成T细胞受体的肽链有α、β、γ和δ四种,γδT细胞表面的TCR是由γ链和δ链组成的异二聚体(TCRγδ)。TCRγδ分子胞外区结构类似于免疫球蛋白,远离细胞膜的一端为可变区,而靠近细胞膜的一端为恒定区。TCRγδ分别由γ基因和δ基因编码。
大多数γδT细胞为CD4-CD8-,即其细胞表面不表达CD4和CD8分子,但有少数可表达CD4或CD8,能够参与免疫调节和免疫应答。在健康成年人体中,γδT细胞占外周血T细胞的1%-5%,它主要分布于肠道、呼吸道以及泌尿生殖道等黏膜和皮下组织,是构成表皮内淋巴细胞和黏膜组织上皮内淋巴细胞(IEL)的主要成分之一。
当前,Adicet Bio正在对γδT细胞进行工程化,以携带针对肿瘤特异性细胞表面或细胞内靶点的嵌合抗原受体(CARs)和T细胞受体(TCRs),以实现精确接触和杀死肿瘤细胞。Adicet Bio计划为各种血液和实体肿瘤癌症以及其他疾病生成多个临床产品候选项。
γδT同时也是全新一代的通用细胞疗法。γδT细胞的独特特性结合了适应性(由γδTCR介导)和先天性(类似NK细胞)的免疫力,可以特异性地识别并消除肿瘤细胞,同时保护正常健康的细胞。与αβT细胞不同,γδT细胞以MHC独立的方式执行其肿瘤杀伤功能,因此可以在同种异体设置中使用,而不会引起移植物抗宿主病(GvHD)。此外,γδT细胞通过自然定位到各种组织进行免疫监视,因此比αβT细胞更有潜力在组织中根除实体肿瘤。Adicet已经在体外和小鼠模型中证明了γδT细胞的细胞毒性和抗肿瘤活性。
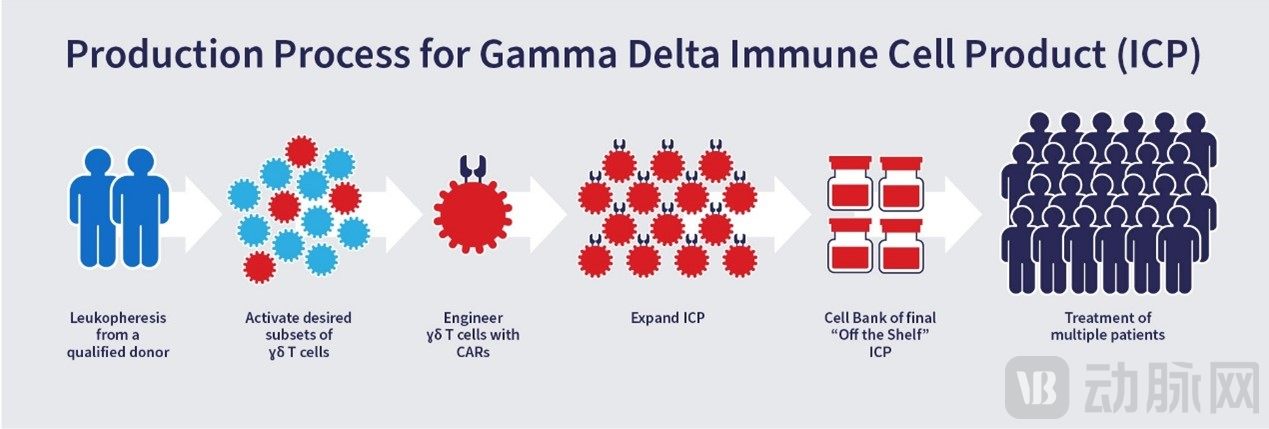
不过,截至目前,γδT细胞的使用仍然受到限制,因为它们仅占外周血单核细胞的一小部分 (1-5%)。为此,Adicet Bio自主开发了一种制造工艺,以激活和扩增γδT细胞的不同亚群,使其数量足以在临床环境中使用。此外,公司还开发了一种专有的细胞平台流程,用于激活、工程化和扩增γδT细胞。
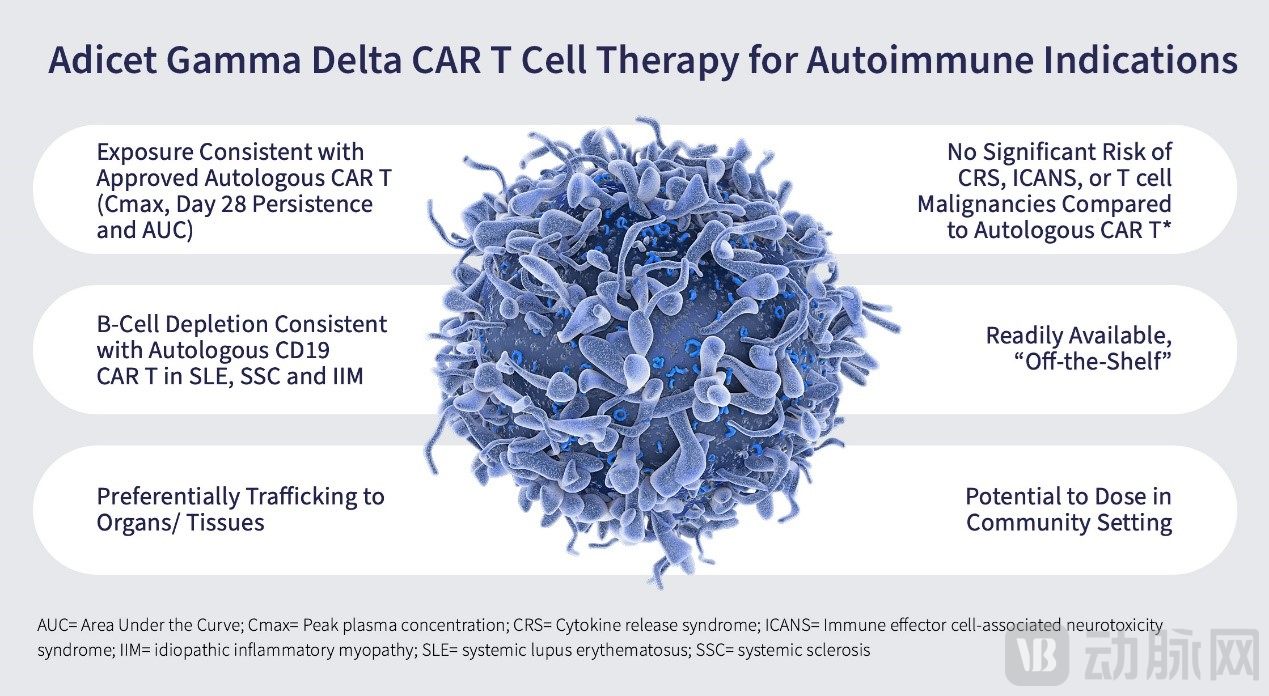
Adicet Bio的主要候选产品ADI-001正是一种在研的同种异体γδ1CAR-T细胞疗法,通过抗 CD20 CAR靶向B细胞。ADI-001主要针对为B细胞介导的自身免疫性疾病和复发或难治性 B细胞非霍奇金淋巴瘤(NHL)。
γδ1T细胞的一个重要优点是它们自然地归巢或运输到组织,并能够精准靶向疾病源头,并减少位于外周组织中的错误B细胞的繁衍,这对于身体器官受损的许多自免疾病患者来说,是一个理论上理想的结果。
安全性方面,ADI-001在临床研究中已被证明具有良好的耐受性,没有显着的CRS(细胞因子释放综合征)或 ICANS(免疫效应细胞相关神经毒性综合征)的发生率,并且与自体CAR T细胞疗法相比,T细胞恶性肿瘤的风险更低。

值得一提的是,Adicet Bio在2021年12月6日宣布,同种异体、“即用型”CD20靶向CAR γδ-T细胞疗法ADI-001的一项剂量递增1期临床试验获得积极中期数据。试验结果表明,ADI-001使B细胞非霍奇金淋巴瘤患者获得75%的客观缓解率(ORR),与50%的完全缓解(CR)。并且,该疗法表现出良好的耐受性特征。
安全性上,ADI-001表现出良好耐受性。未报告剂量限制性毒性、移植物抗宿主病(GvHD)、免疫效应细胞相关神经毒性综合征(ICANS)或3级或以上细胞因子释放综合征(CRS),显示出ADI-001具有较宽的潜在治疗窗。
此外,在晚期癌症患者中,ADI-001作为单药疗法治疗从3000万个CAR-T细胞的最初剂量水平开始,观察到积极的早期完全缓解。
而在最近一次、即第65届美国血液学会(ASH)上,Adicet Bio进一步公布了ADI-001的1期临床亮眼数据。
ADI-001展现了强烈的暴露曲线,并且该暴露与药效动力学(PD)相关性和临床反应之间呈正相关关系,具体情况如下:
在剂量水平3(DL3)和剂量水平4(DL4),ADI-001的最大血药浓度(Cmax)和达峰时间(Tmax)达到或超过了已获批的自体CD19 CAR T疗法的处方信息标准。
随着剂量水平的增加,Cmax和药时曲线下面积(AUC)也相应升高,并且这些参数与患者的临床反应密切相关。
ADI-001的刺激和增殖与CAR+细胞的峰值水平以及多功能细胞因子的较高产生量相关,特别是在那些总体反应最佳(完全反应或部分反应)的患者中表现更为显著。
内源性细胞因子水平(包括干细胞因子和IL-15)的升高可能促进了ADI-001的扩增和临床反应的增强。
此外,ADI-001的暴露程度或临床反应与患者和ADI-001之间共享HLA等位基因的程度没有显示出相关性。
进入1期即可领跑
参考往期临床数据,通用型CAR-T和自体CAR-T相比,无论是疗效还是持久性都还存在着一定的差距。且受限于免疫排斥反应,通用型CAR-T往往能做到低价,但难以做到高效,现实依然骨感。
因此,通用型CAR-T要在赛道逆风翻盘,甚至后续力压自体CAR-T疗法,就不能仅仅依靠低价来竞争,而应在疗效和持久性方面深耕。毕竟,随着工艺的成熟,自体CAR-T疗法的降价也将成为必然。这便解释了为何ADI-001此次最大血药浓度(Cmax)和达峰时间(Tmax)的公布意义非凡。
而Adicet Bio布局的γδT细胞疗法,国内也有传奇生物、博生吉等企业也均有管线推出。其中值得一提的是,传奇生物的生产工艺,可以产生差异化的CAR-NKγδT细胞。旗下管线LB2103为传奇生物开发的BCMA CAR-γδT细胞疗法,细胞因子释放明显少于CAR-T,但疗效超过CAR-T,有望成为更有效更安全的多发性骨髓瘤细胞疗法。
博生吉则根据Allogenic UCAR-61T平台,开发出五款γδT细胞药物,作用靶点有CD19、B7-H3和BCMA等。
总体而言,国内的γδT细胞疗法仍处在临床前阶段;全球已注册的γδT细胞疗法临床试验主要集中在I期阶段,Adicet Bio正处于这场竞赛中的第一梯队。不过,Adicet Bio能否成为真正的胜出者,自身还需面对随之而来的疗效、量产等多重挑战。横向来看,自体CAR-T的降价趋势会随着技术成熟凸显,而自体和异体CAR-T之间,似乎仍欠一场头对头试验。此外,已顺利进入临床的通用型CAR-T企业则会经历更为激烈的角逐。





























