2月28日,永泰生物制药有限公司(股票代码:06978.HK,简称“永泰生物”)宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)同意其为核心产品候选药物EAL®提交附条件批准申请。
公告提及,永泰生物计划将于近期提交EAL®的新药上市申请,有望成为国内首个获批上市的CIK(细胞因子诱导的杀伤细胞)疗法。
EAL®为一款广谱性的细胞免疫治疗产品,此前已成为国内首款获准进入实体瘤治疗Ⅱ期临床试验的免疫细胞治疗候选产品。2023年9月,EAL®成功被纳入CDE突破性治疗品种名单,适应症为原发性肝细胞癌外科根治术后的预防复发。
一旦获批上市,EAL®将改变肝癌术后复发无有效治疗药物的现状,也将成为国内首个获批上市的实体瘤细胞治疗产品,迅速打开实体瘤细胞免疫治疗的广阔市场。
1首款实体瘤细胞治疗产品,附条件批准打开肝癌关键市场
EAL®全称扩增活化的淋巴细胞(Expanded Activated Lymphocytes),为广谱、多靶点细胞免疫治疗产品,最初取自患者自体外周血中的T细胞,经使用专利方法活化、扩增培育而成的制剂,以CD8+杀伤性T细胞(表面标记为CD3分子)为主要活性成分。
从作用机制来看,EAL®是通过在体外激活并扩增来源于患者自身具有抗肿瘤活性的T细胞,输注给患者自身,以预防肿瘤的复发。EAL®产品的目标对象为可以接受肝切除的肝细胞癌(HCC)患者。这些患者处于I/II/III期,占全部HCC患者的70.2%。因此,EAL®的可医治HCC患者被视为占中国市场全部HCC患者的70.2%。
据世界卫生组织国际癌症研究机构(IARC)数据,2022年中国癌症新发病例中,肝癌居于第4位,致死率在所有癌症中排名第二,约为37万例。肝癌分为原发性肝癌和由其他病灶转移后所引发的继发性肝转移,原发性肝癌始于肝组织,其中最常见的为肝细胞癌(HCC),约占整体原发性肝癌的90%。
纳入突破性治疗品种名单、同意提交附条件批准申请,接连迎来重大监管进展的关键在于EAL®突出疗效数据及充分的人体试验案例,也对应着细胞治疗最引人关注的两大话题——疗效与安全性。
首先需要理解EAL®作用机制的本质——CIK细胞。作为一类特异性免疫细胞,CIK细胞需要细胞因子激活,对肿瘤细胞拥有很强的识别能力,通过直接及间接方式精确杀伤肿瘤细胞,而不对正常细胞造成伤亡。此外,研究显示,CIK细胞具有增殖速度快、强大抗瘤活性、广谱抗病毒的特点。
截至2022年,美国临床试验数据库显示,CIK/DC-CIK细胞治疗的相关临床研究有108项,涉及的疾病主要包括胰腺癌、胃癌、食管癌、膀胱癌、难治性非霍金奇淋巴瘤、结直肠癌、肺癌、肝癌、肾癌、三阴性乳腺癌、急性白血病、B细胞淋巴瘤症实体瘤和血液瘤。
安全性方面,永泰生物招股书显示,2006年11月至2016年4月,EAL®已经作为三类医疗技术在临床上治疗了数十家医院、4000多例癌症患者,累计回输超过20000次。 主要适应症包括肺癌、肝癌、肠癌、胃癌、白血病、乳腺癌、卵巢癌、子宫癌、肾脏相关癌症、 食管癌、淋巴瘤及黑色素瘤,当中大多数为实体瘤。
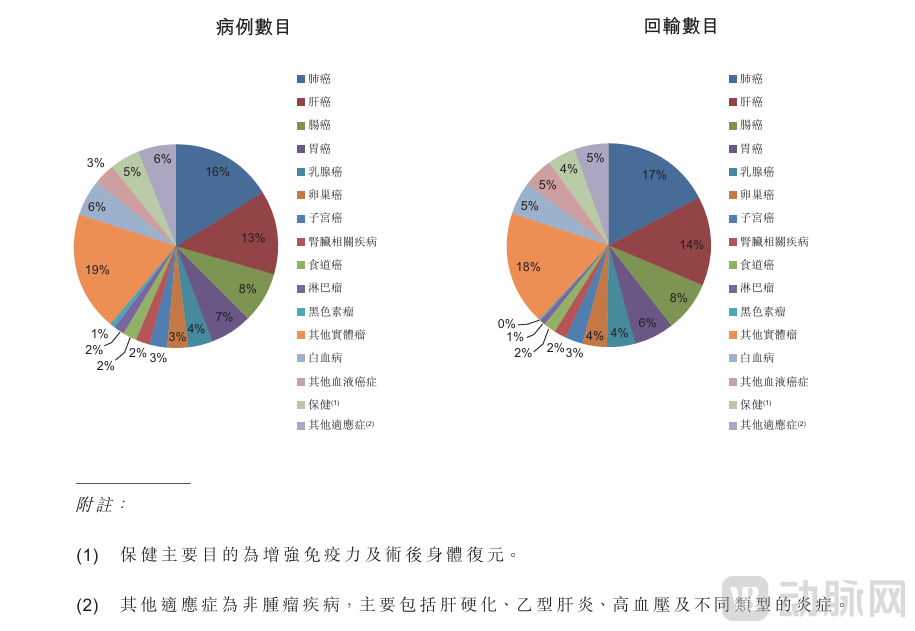
双轨制实施前及实施期间已在临床上应用及商业化的EAL®就各种肿瘤适应症中的病例数目及回输数目
目前,EAL®公开临床数据有限,大部分来自早期临床研究者的SCI期刊文章:
中国医学科学院北京协和医院一份临床研究中报告,共有19名已出现转移的晚期恶性肿瘤患者接受了EAL®注射。在注射EAL®细胞后的二至四周,患者外周血中CD3+CD8+(CD8+杀伤性T细胞)及CD3-CD56+(自然杀伤细胞)亚群比例均有所提高。此外,根据报告,分泌IFN-γ的细胞数量在EAL®注射后大幅增加,其中CD3+IFN-γ+及其淋巴细胞p值分别为0.006及0.015。更进一步的结果表明,注射EAL®后,CD3+CD8+及CD3–细胞亚群中分泌IFN-γ细胞的比例均大幅提高,这表明EAL®具有增加外周血中抗肿瘤杀伤性淋巴细胞数目的能力,且具有增强抗肿瘤免疫作用。
同时,注射过程中并未出现II级或以上的严重毒性反应。在所有19名患者中(包括细胞表型变化未经分析的六名患者),七名患者出现了I级毒性反映。这些不良事件都具有自限性,发烧及眩晕不超过48小时,腹泻不超过12小时,寒颤不超过三小时。于注射期间或之后的各个病例均无须特殊处理,且并未观察到严重不良反应。
中国人民解放军总医院张国庆等教授收集的临床应用数据显示,在84名IIIc至IV期胃癌患者中,有42名患者接受6次以上的EAL®注射及42名患者进行同期对照,EAL®治疗组的总生存期(OS)为27.0个月,而对照组为13.9个月。EAL®免疫治疗降低了42.7%的死亡风险。
另一项有关应用EAL®治疗小细胞肺癌的研究显示,从32名患者收集的数据中(治疗组与对照组各有16名患者),EAL®治疗组患者均经过六次以上的EAL®注射治疗,其OS在数值上较对照组有所延长,尽管两者的差异未呈现统计学意义(p=0.060,HR=0.487,95%置信区间0.228 1.037)。EAL®治疗组患者的一至三年生存率在数值上亦较对照组好,但两者的差异亦无统计学意义(p>0.05)。
2踩准细胞治疗发展节点,能否乘上附条件批准上市的“排他性”东风
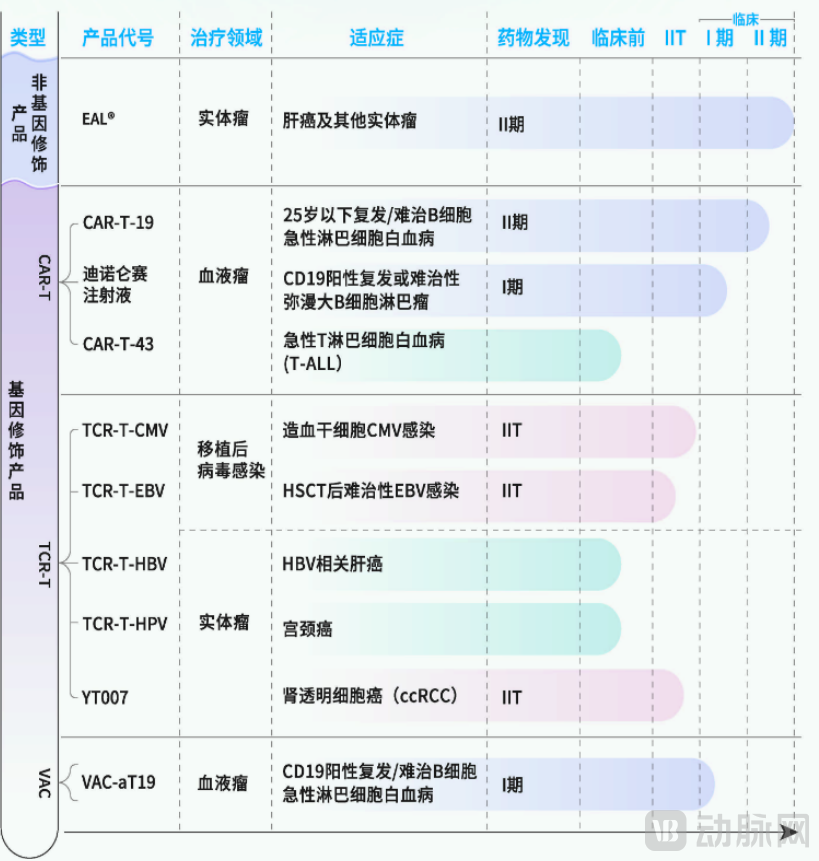
2006年,永泰生物成立,始终致力于肿瘤治愈性免疫细胞药品的研发与商业化,产品管线覆盖非基因改造及基因改造产品,以及多靶点及单靶点产品等主要类别的细胞免疫治疗产品。
2015年,国家卫生健康委员会发布《关于取消第三类医疗技术临床应用准入审批有关工作的通知》取消第三类医疗技术临床应用准入审批。同年,永康生物提交EAL®的IND申请,并获得药品审评中心受理。
2017年《药品注册管理办法》和《生物制品注册分类和申报资料要求》修订稿发布,将细胞治疗类产品纳入药品管理审批。同年10月,EAL®获得IND批件。2018年开展了一项在原发性肝细胞癌外科根治术后预防复发的Ⅱ期临床研究,招募入组430名受试者,9月入组第一例II期临床试验患者。
2020年,永泰生物成为我国首家在港交所上市的免疫细胞药品企业。无论是踩中风口还是运气使然,技术实力和产品稳定性都是永泰生物抓住每个节点的关键。与其说是踩准发展节点,不如说永泰生物即为国产细胞治疗企业发展的缩影。那么,获批上市与商业化的关键时刻,永泰生物能否走通“药品附条件批准上市”这一快速上市路径就至关重要。
可见的一重利好是,根据2023年《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》,某药品获附条件批准上市后,原则上不再同意其他同机制、同靶点、同适应症的同类药品开展相似的以附条件上市为目标的临床试验申请。同时,明确附条件批准前就要开启确证性研究,并且要求4年内完成确证性研究。
对于永泰生物这类最快冲线的排头兵,先发优势将被进一步强化,形成政策与市场独占性的两重优势。与此同时,充分的早期临床有效性、安全性数据也将形成市场认可度、临床推广等隐形优势,助力上市、临床及确证性研究进程。
正如业内对于细胞治疗的广泛期待,EAL®广阔天地不止于此。
如果走通肝癌首发适应症、成为国内首个获批上市的实体瘤细胞治疗产品后,EAL®拥有着广泛的潜在广谱抗癌市场。多项早期人体试验临床研究显示,EAL®对治疗肝癌外的多种肿瘤具有功效。永泰生物也在加速扩大适应症的研究工作,包括胃癌、肺癌、结直肠癌、脑胶质瘤等疾病。