11月10日,上海微知卓生物科技有限公司(后简称“微知卓”)受邀在美国肝病研究学会(AASLD)2025年年会,口头报告其新型生物人工肝(HepaCure)在慢加急性肝衰竭受试者的I期临床试验数据,并获得AASLD 2025年度“临床/转化科学领域青年研究者奖”。
在此项历经8个月的多中心、开放标签的I期临床中,HepaCure在主要终点与次要终点方面均达到预期:受试者完成治疗成功率100%;治疗相关的不良事件(TEAE)均CTCAE分级<3级,没有观察到与HepaCure相关的SAE;整个试验期间未发生造成治疗停止的器械缺陷,受试者整体上呈现肝功能好转、凝血功能改善趋势。
结果表明,HepaCure显示出良好的安全性和耐受性,具有潜在的肝功能改善作用,有望成为治疗慢加急性肝衰竭的新方法。这也是中国首个生物人工肝临床试验,目前已顺利进入Ⅱ期临床试验。
1中国科学院成果转化,全球首个直接转分化产生功能肝细胞的技术
在全球范围内,每年约有200万人因肝病死亡,占所有死亡人数的4%,绝大多数死于慢性肝病及其并发症。中国是肝脏疾病多发大国,约有3.4亿~4.8亿慢性肝病患者,肝脏疾病负担沉重。其中,肝衰竭每年的新发患者人数大于50万,且90天死亡率约为50%,是进展最快、最凶险、预后最差的临床常见肝病症候群。
在临床实践中,慢加急性肝衰竭(ACLF)治疗措施以内科综合治疗为主,必要时辅助非生物型人工肝、肝移植治疗。然而,由于肝源紧缺、移植后免疫排斥及高昂的医疗费用等因素限制,每年仅约五六千例患者能够获得肝移植治疗,大量患者在等待合适肝源的过程中不幸离世。
在治疗手段方面,人工肝技术通过体外透析的方式,暂时替代衰竭肝脏的部分功能,提供肝功能支持,促进患者自体肝脏的恢复,为患者争取宝贵的生存期与肝移植等待时间,最终帮助患者实现肝脏再生。
目前,非生物型人工肝已在临床广泛应用,已被证明可有效清除有害物质,但不具备蛋白合成的功能。而生物人工肝则构建了更接近生理状态的肝功能支持系统。早期的生物人工肝受限于肝细胞来源,多采用动物肝细胞或人肝肿瘤细胞作为种子细胞。
微知卓生物自主研发的新型生物人工肝(HepaCure),即以人源诱导肝样细胞(hiHep)为核心的血浆生物净化柱系统。
通过功能性肝细胞(hiHep细胞),提供生物合成和代谢解毒的功能,血浆流经hiHep细胞后,清除多种内外源性有害物质,分泌肝脏特异性蛋白(如ALB、AAT、TRF等),进而降低炎症反应、减少细胞死亡、促进细胞再生。
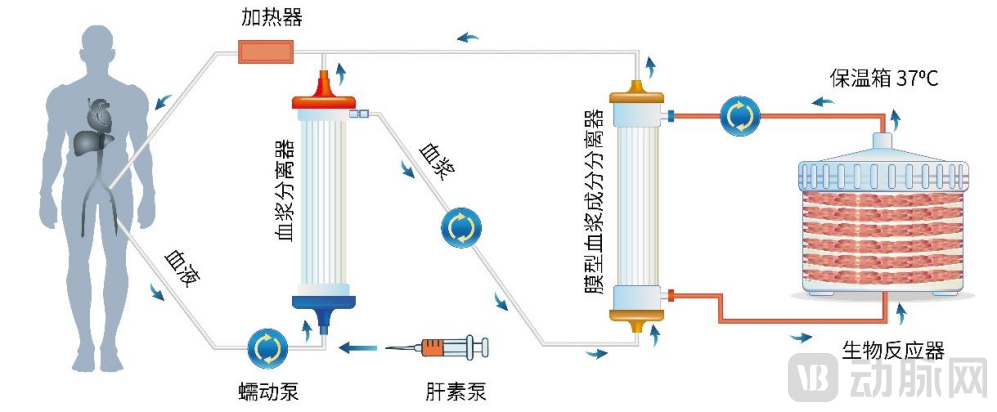
血浆生物净化柱系统概念图
生物人工肝产业化成功与否的核心,在于如何获取到安全、有效、可大规模扩增的种子细胞。
微知卓的技术根基,是一项载誉而来的科学突破——曾获2011年度“中国科学十大进展”肝细胞转分化技术。这一里程碑式工作的核心,是创始人惠利健教授在《Nature》上发表的颠覆性成果:首次实现了将小鼠成纤维细胞直接重编程为功能性肝细胞,解决了肝细胞来源这一关键难题。
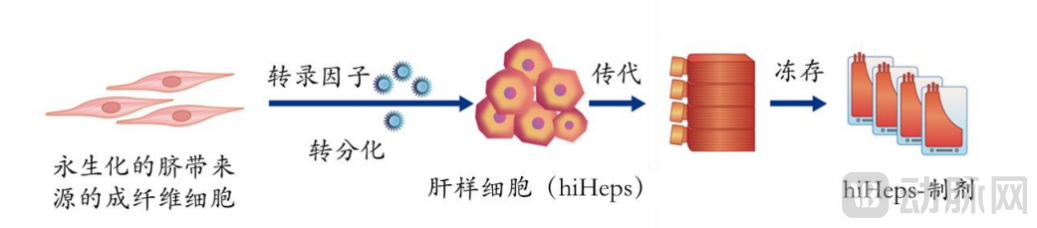
hiHep细胞制备流程图
2014年,惠利健教授团队首次实现将人成纤维细胞直接转分化为人源性肝样细胞(hiHep细胞)。该细胞同时具备多种肝特异性蛋白质表达和代谢解毒功能,并可以大规模扩增。“从体细胞直接转分化而来意味着全人源、安全;生成肝细胞功能稳定意味着能够有效应用;大规模扩增则代表着可达到临床治疗所需要的细胞数量级,为产品的商业化奠定基础。”微知卓生物董事长潘国宇博士在接受动脉网采访时提到。
2完成治疗成功率达100%,指向临床急需的肝衰竭治疗
此次I期临床的适应症——慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是一种发生在慢性肝病基础上的急性肝功能失代偿,短期病死率高,是造成慢性肝病患者死亡的主要原因之一。以往研究中,28天死亡率高达24.8%~58.3%。
潘国宇博士强调:“我希望行业内不要把生物人工肝看得非常特殊,它就是一个药械组合的细胞治疗产品,而且是First-in-Class的一类新药,遵循创新药审批标准。创新药所遇到的考验都是团队会经历的,只是根据产品特点,在临床方案设计、评审审查上会有一些侧重点的不同而已。”
在多中心、开放标签的I期临床试验中,主要终点数据显示,受试者完成治疗成功率100%,HepaCure治疗安全可耐受;治疗相关的不良事件(TEAE)均CTCAE分级<3级,没有观察到与HepaCure相关的SAE;整个试验期间未发生造成治疗停止的器械缺陷。次要终点指标上,受试者整体上呈现肝功能好转、凝血功能改善趋势。具体表现在——治疗后14天,AST、ALT及TBIL下降,PTA及ALB 升高。
作为中国首个生物人工肝临床试验,微知卓目前正在开展Ⅱ期临床试验,将进一步拓展HepaCure的探索性临床及确证性临床数据。
与此同时,微知卓也在积极探索HepaCure在肝癌患者大肝切术后康复治疗的新适应症。IIT研究中显示出良好的安全性,可改善患者肝功能,促进肝脏再生。
3肝细胞体外扩增技术的临床应用:体内肝细胞移植及体外药物筛选
2018年,惠利健教授团队建立了全新的人肝细胞体外扩增理论和培养体系(特殊培养基),构建了可增殖的人原代肝细胞(Proliferating Human Hepatocytes,ProliHH),真正实现人原代肝细胞10000倍以上的体外大规模扩增。
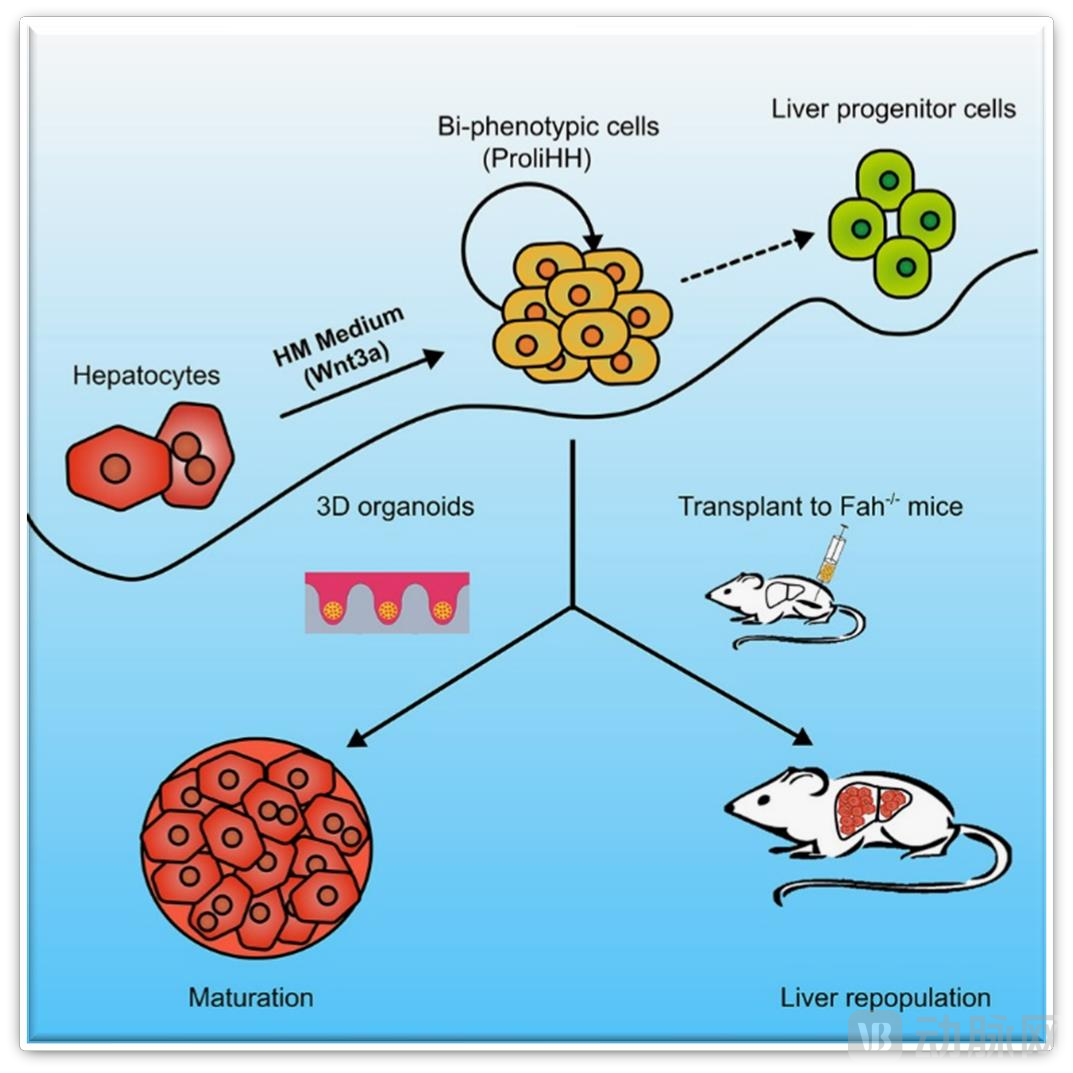
这一技术已于2018年发表在Cell Stem Cell上。动物实验数据显示,移植的ProliHH在降低小鼠肝损伤和提高小鼠生存率等方面表现出与原代肝细胞类似的治疗效果。
2025年7月,惠利健教授团队在《Nature Protocols》上发表论文,阐述了一套完整的实验流程:将PHHs诱导为增殖型人肝细胞(ProliHHs),通过优化培养基系统实现其大规模扩增,并结合三维培养与CRISPR基因编辑,探索其在疾病建模与治疗中的潜力。
研究显示,将ProliHHs通过脾内注射方式移植至FRG免疫缺陷小鼠体内,模拟肝细胞替代疗法。术后5个月检测显示,移植细胞在小鼠肝脏中稳定表达人源GAPDH,证明其具有良好的体内嵌合与长期生存能力,验证了其在细胞治疗领域的应用潜力。
这提示,ProliHH技术产业化将有望应用于肝细胞移植治疗重症肝病,包括肝硬化、遗传代谢性肝病等。底层逻辑上,微知卓独有的ProliHH技术实现体外大规模扩增,解决了肝细胞来源不足的挑战,且拥有更高的批次间稳定性和一致性。目前,相关管线正在开展IIT研究。
另一层面上,原代肝细胞(Primary Hepatocytes)具有完整的细胞特性和生理水平的酶和辅助因子,拥有肝脏中所有的代谢途径,因此被广泛认为是构建体外肝脏模型的金标准,在药物相互作用、药物代谢和药物毒性研究中受到研究者的青睐。不同供体来源的ProliHH能够在体外快速成熟,其肝基因、功能表现与人原代肝细胞类似,可以用于基础研究和多种药物研发领域。对此,微知卓正在拓展ProliHH应用于药物筛选等研发服务。
潘国宇博士认为:“如果我们将肝癌细胞放入微流控体系,它无法自组装为多层血管结构。但应用体外扩增(如ProliHH)或体内诱导的新生肝细胞,我们能够观察到细胞各方向是不均一的,血管面、胆管面都有了明显的极化表现,这意味着其通过自组装已经形成具备一定生物功能的细胞球,这就是最基本的类器官。进一步地,通过微流控、多层细胞补片等方案,可将其组装成更复杂的结构及生理系统。”
2007年潘国宇博士加入诺华,从事药物肝脏代谢和安全性评价工作,2008年担任诺华全球药物转运体委员会副主席和转化机制实验室主管。他提到,高通量筛选、类器官等产品的应用落地,关键在于精准洞察一线研发人员的真实需求,并将其转化为以结果为导向的解决方案,进而切实兑现产业端的实用价值。
在可见的未来,微知卓仍在持续探索生物工程器官移植、体内肝脏细胞诱导方向。此前,惠利健教授在接受采访时表示,下一步研究方向是直接在肝脏损伤患者体内高效诱导出足够的新生肝脏细胞。





























