另一只靴子终于还是要落地了。
继上周在众议院获得投票通过后,搭载修订版《生物安全法案》的美国2026财年《国防授权法案(2026NDAA)》,于北京时间12月18日凌晨,以77票赞成、20票反对的结果,在参议院获得通过。至此,2026NDAA现已完成国会两院的主要立法程序即将送往白宫,由美国总统签署后立即生效。
这份法案之所以受到生物医药行业关注,是因为纳入了此前颇有争议的《生物安全法案》。
在美国,一项法案的立法路径有单独立法和包裹立法两类。此番《生物安全法案》是通过后者完成立法,即作为《国防授权法案》的一个条款来简化审议和投票流程。历时近2年,美国《生物安全法案》即将完成立法。根据《生物安全法案》,美国行政机构将被禁止与受关注的生物科技公司,进行直接或者间接的合作。
尽管相对最初提案,最终生效的《生物安全法案》稍显温和,比如不再点名具体企业、设置清单企业的申诉和移除机制、缓冲期最长近8年等,但在业界看来,这份法案的生效,将对中美生物医药行业的发展产生深远的负面影响。
两项禁令
在这份美国2026财年《国防安全授权法案》中,《生物安全法案》被放在一个单列章节中(sec.851),全称为PROHIBITION ON CONTRACTING WITH CERTAIN BIOTECHNOLOGY PROVIDERS,即禁止与特定生物技术供应商签约法案,这与此前多个版本的《生物安全法案》提案一致。

具体来看,《生物安全法案》的核心内容,是针对受关注生物技术公司的两项禁令。第一,禁止美国行政机构负责人采购或获取由受关注生物技术公司生产或提供的任何生物技术设备或服务;第二,禁止美国行政机构负责人与符合条件的实体签订、续签或延长合同,以及为这些用途划拨或支出贷款、拨款资金。如果在《生物安全法案》生效时,贷款或拨款已经发放,接收方也不得使用这笔资金。
其中,第二条禁令所指符合条件的实体,包括2类。第一类,在履行与该行政机构所签合同过程中,使用了《生物安全法案》生效日期后获取的、由受关注生物技术公司生产或提供的生物技术设备或服务的实体;第二类,签订的合同在履行时,明知将需要使用本条款生效后获取的、由受关注生物技术公司生产或提供的生物技术设备或服务的实体。
根据第二条禁令,除了直接和受关注生物技术公司进行交易,与采用或者将采用受关注生物技术公司提供的生物技术设备、服务的对手公司发生的交易,也被禁止,并且这种交易除了合同交易,还包括贷款、拨款等资金交易。而这一点至关重要,在美国,许多采用了生物技术或者可能采用生物技术的公司和项目,都得到了联邦政府的资金支持。由此,《生物安全法案》的第二项禁令将可能波及在美国开展的大量生物科技相关项目。
几个关键词
读懂这份禁令,还需要弄清楚几个关键词,即受关注生物技术公司、生效日期、生物技术设备或服务,我们逐一来看。
首先是受关注的生物技术公司。两条禁令都围绕受关注生物技术公司展开,这是《生物安全法案》中最核心的关键词。受关注生物技术公司清单上的实体,包含被列入第1260H条的特定实体、根据特定程序认定的其他实体及存在一定关联关系的实体。
具体来说,第一类清单实体,是被列入了美国国防部每年在《联邦公报》发布的,在美国运营的中国军工企业清单,并且在一定程度上参与生物技术设备或服务的制造、分销、提供或采购的公司。由于这份清单的发布依据是《2021财年威廉·M(麦克)索恩伯里国防授权法案》第1260H条,这个部分的实体也被外界称为第1260H条实体。
这里稍作展开。《2021财年威廉·M(麦克)索恩伯里国防授权法案》第1260H条,是《生物安全法案》之外,另一个颇受中美企业关注的法条(以下简称“第1260H条”)。作为美国针对 “中国军事公司” 设立清单管理制度的核心条款,第1260H条要求美国国防部长识别并公布在美国直接或间接运营的中国军事公司清单,从而管控中国军民融合企业对美国家安全的潜在影响。目前,国内的华大基因、华大智造、原能细胞被列入这份清单,Complete Genomics、华大时空组学、诺维赞、安序源等企业被美国议员提议纳入清单。
第二类清单实体,是根据实体建议清单被认定的实体。实体建议清单,则由美国国防部长,协同司法部部长、卫生与公众服务部部长、商务部长、国家情报局局长、国土安全部长、国务卿及国家网络安全总监提出。《生物安全法案》发布后1年内,美国行政管理和预算局应该发布第1260H条实体之外的受关注生物科技公司清单。
第1269H条实体之外的受关注生物科技公司清单的列入标准,包括被认定受外国对手政府的行政管治架构管辖、指导、控制,或代表该政府开展运营,并且在一定程度上参与生物技术设备或服务的制造、分销、提供或采购,同时对美国国家安全构成威胁的实体。所谓对美国国家安全构成风险,具体是指与外国对手的军队、国内安全部队或情报机构开展联合研究、接受其支持或与其存在关联,或者向外国对手政府提供通过生物技术设备或服务获取的多组学数据,或者在未获得明示且知情同意的情况下,通过生物技术设备或服务获取人类多组学数据。
第三类,是作为前述两类实体的子公司、母公司或承继实体,并且这些子实体也被认定,受外国对手政府的行政管治架构管辖、指导、控制,或代表该政府开展运营,并且在一定程度上参与生物技术设备或服务的制造、分销、提供或采购,同时对美国国家安全构成威胁的实体。
这份清单并非一成不变。《生物安全法案》要求,至少每年对受关注生物技术公司清单进行一次审查,并酌情增列或移除相关实体。此外,对于已经被列入受关注清单的生物技术公司,如果企业认为自己不再符合标准,可以向美国行政管理和预算局局长提交相关信息及论证材料,申请将其从清单中移除。局长应在收到申请后90天内对该申请进行审查并作出答复。
其次是生效日期。《生物安全法案》的两项禁令,需要通过修订《联邦采购条例》来生效,这可能是一个颇为漫长的流程。
在受关注生物技术公司清单发布或更新后,需要美国行政管理和预算局局长应协同美国国防部长、司法部长、卫生与公众服务部长、商务部长、国家情报局局长、国土安全部长、国务卿及国家网络安全总监,制定指导意见。然后,再由联邦采购监管委员会依据指导意见修订《联邦采购条例》。
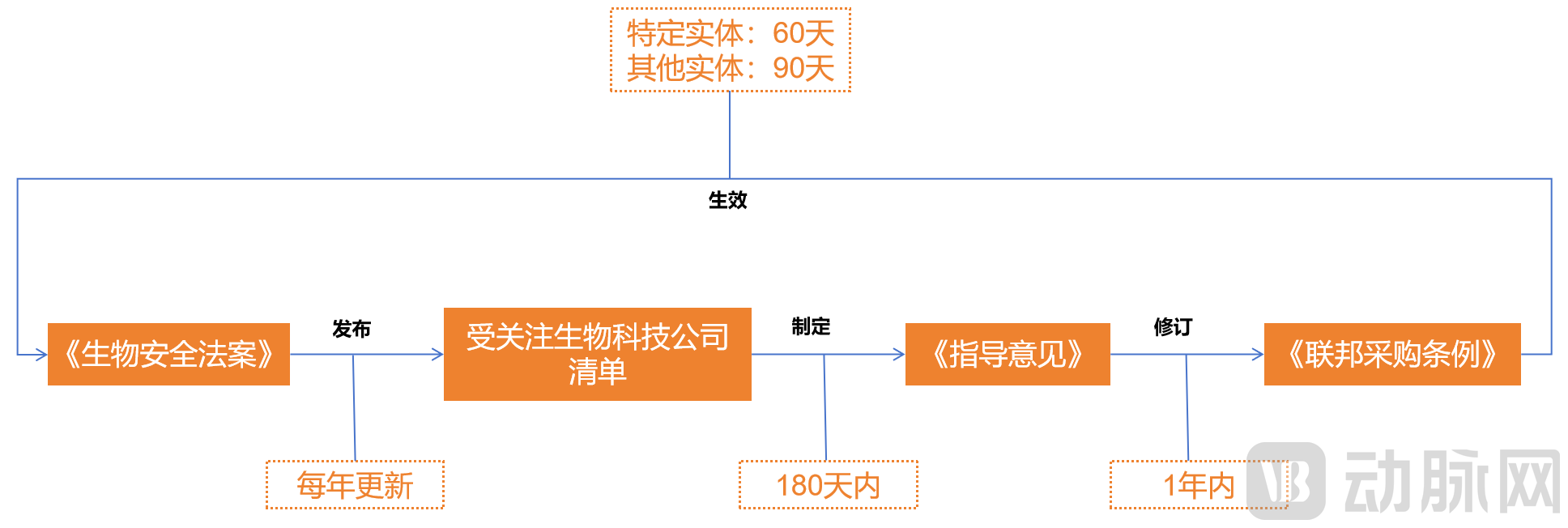
根据《生物安全法案》,制定指导意见的缓冲期,是受关注生物科技公司清单发布或者更新后的180天;而修订《联邦采购条例》的缓冲期,是制定指导意见后1年;而从《联邦采购条例》修订,到《生物安全法案》的两项禁令生效,仍有数月的缓冲期。其中,针对特定实体,禁令生效缓冲期为60天;针对其他实体,禁令生效缓冲期为90天。
换言之,对于第1260H条实体,从《生物安全法案》完成立法到最终生效,中间有最长1年多的缓冲期;而对于第1260条实体之外的认定实体,最长缓冲期超过2年。
最后来看生物技术设备或服务。《生物安全法案》所指的生物技术设备或服务包含3大类。第一类,设计用途为用于生物材料的研究、开发、生产或分析的各类设备,比如基因测序仪,或者其他仪器、装置、机器及设备(含其部件和配件)。同时,为这些设备专门设计,且对其运行必不可少的软件、固件或其他数字组件,也属于生物技术设备或服务范畴。
第二类,与生物材料相关的研究、开发、生产、分析、检测或信息提供服务,包括数据存储和传输服务。具体而言,这里是指,与前述仪器、装置、机器或设备的使用或应用相关的咨询、顾问或支持服务,和疾病检测、谱系信息及相关服务。
第三类,美国行政管理和预算局局长协同各行政机构负责人,基于国家安全利益酌情认定的、其他用于生物材料研究、开发、生产或分析的服务、仪器、装置、机器、部件、配件、设备、软件或固件。
《生物安全法案》变温和了吗?
自2023年底被提出以来,《生物安全法案》的立法之路几经周折。
2023年12月,美国参议院S.3558提案形成,这是《生物安全法案》最早的版本。S.3558提案提议,从国家生物安全的角度考虑,应该禁止与药明康德、华大基因及其相关公司等5家中国生物技术供应商签订的合同。2024年1月,美国众议院提出《生物安全法案》草案,是为“H.R.7085号草案”。
2024年5月,美国众议院经过调整,提出著名的H.R.8333法案,也就是外界熟悉的第一版《生物安全法案》。不过,这版《生物安全法案》没能纳入当年的《国防授权法案》来“搭车”立法,独立立法之路也在当年9月中断。
此后,关于《生物安全法案》的讨论曾一度平息,直到2025年夏天,美国参议员比尔・哈格蒂和加里・彼得斯提出新一版的《生物安全法案》。2025年10月,2026年度《国防授权法案》在参议院投票通过,新版《生物安全法案》作为附加条款被纳入其中,立法前景变得明朗。
外界普遍认为,相比最早出现的《生物安全法案》,最终立法的文本迫于外界压力进行了一系列调整,已经变得颇为温和。其中,《生物安全法案》变得温和最直接的证据,是删除了对具体公司的直接点名,全文不再出现华大基因、药明康德等5家中国企业。不过,由于已经被列入第1260H条清单,华大基因、华大智造等国内企业仍不免被波及。

在动脉网看来,《生物安全法案》确实做了一些对产业更友好的调整,但相比2024年9月版的H.R.8333法案,最终文本最重要的变化,是稍微多留了一点余地。
一方面,受关注生物科技公司清单可以接受申诉,部分公司可能被移除。根据最终的《生物安全法案》,对于已经被列入受关注清单的生物技术公司,如果企业认为自己不再符合标准,可以向美国行政管理和预算局局长提交相关信息及论证材料,申请将其从清单中移除。而在此前的版本中,没有这样的规定。另一方面,针对禁令生效前就存在的合同,统一给出5年缓冲期,而在H.R.8333法案中,自2032年1月1日起,第1260H条实体的现存合同就不再具有缓冲期。
总体而言,无论是删除具体公司名称,还是增加移除机制、留出缓冲期,这些缓和措施的作用仍十分有限。
毕竟法案带来的影响并非只波及短期订单,而是打击增量业务。以国内头部CRO为例,一直以来,近2/3的收入来自美国客户,尽管延长了的缓冲期可以保住存量订单,但潜在的客户可能在前期做决策时,就倾向于避开中国供应商。当然,禁令不光影响中国企业。数据显示,近80%的美国生物制药公司与中国供应商存在合作。一旦与中国企业断链,美国本土药物研发供应链可能面临瘫痪风险,而建设新供应链,远非短期内可能完成的任务。
如今,《生物安全法案》正式发布,后续将产生怎样的影响,动脉网将持续关注。





























