当地时间2026年1月12日至15日,第44届摩根大通医疗健康大会(JPM2026)如期在美国旧金山举办。作为全球医药健康领域顶级的盛会,JPM期间是创新药资产交易最密集的时候,重磅交易频出。而这些重磅交易,往往会成为一年创新药BD和开发的风向标。
对于中国创新药而言,JPM有着里程碑式的意义。从近20年前的外围参会,到如今入主主会场,JPM见证了中国创新药在全球舞台上的成长。JPM 2026,共有24家中国创新药企在主会场和亚太专场亮相,还有更多的中国创新药企,在JPM 2026期间完成与MNC的重磅BD交易。在ADC、代谢疾病、细胞与基因治疗等JPM 2026上的热门领域,中国创新药已经成为不可或缺的价值输出方。
中国创新药管线走线世界舞台的中心
尽管在会前有分析认为,MNC与中国创新药结束了蜜月期,资产合作热度正在下降,但JPM 2026期间密集的重磅BD交易表明,专利悬崖倒逼之下,中国仍然是MNC扫货的重要目的地。更重要的是,在JPM 2026,中国创新药不再只是抬头看风向标,从MNC的只言片语中摸索一年的行业趋势,而是作为新趋势的推动者。
在本文中,我们尝试基于JPM 2026期间的动向,找出可能改变2026年竞争格局的中国创新药企。在2026年,MNC买入中国创新药资产,甚至重磅BD,已经是全球制药生态中的常规事件。眼下,足以影响细分领域竞争格局的,是在新的周期,中国创新药资产给临床实践带来的切实变化。其中,我们会重点关注因为有MNC加持而进入新周期的中国创新药资产。
BD交易热之下,热门靶点竞争格局被撬动
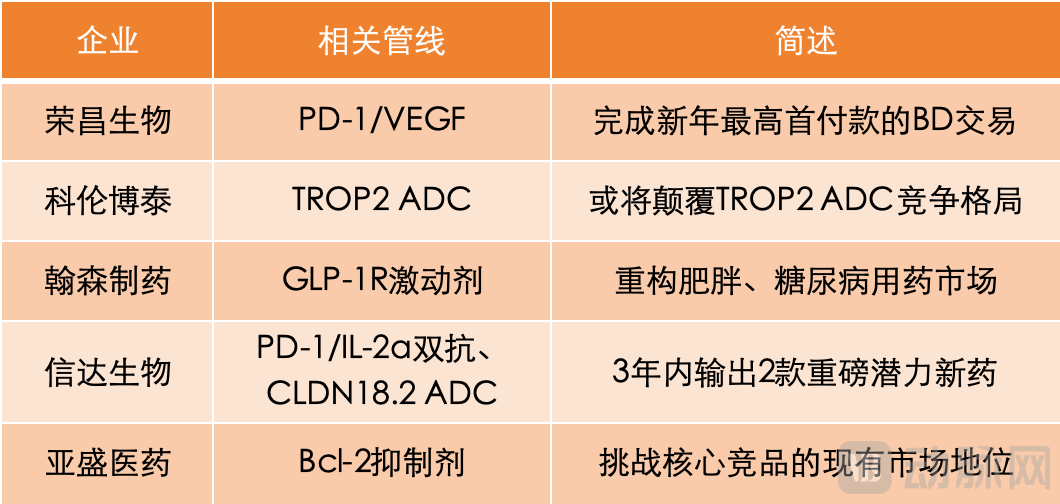
荣昌生物,完成新年最高首付款的BD交易。JPM 2026首日,荣昌生物率先发布公告,称与艾伯维签署独家授权许可协议,将在研产品RC148在大中华区以外地区的开发、生产和商业化的独家权利授权给后者。为此,荣昌生物将收到6.5亿美元(约合人民币45.33亿元)的首付款,并有资格获得最高达49.5亿美元的开发、监管和商业化里程碑付款,以及在大中华区以外地区净销售额的两位数分级特许权使用费。此后,赛神药业、先声再明等国内创新药企也相继发不与在诺华、艾伯维等MNC的重磅交易。
这是JPM 2026议程正式启动后敲定的首笔BD交易,也是4天会期中首付款最高的BD交易,刷新了国内创新药单一管线BD首付款的记录。
RC148是一款PD-1/VEGF双抗,目前正处于国内和全球的多项III期、II期临床试验中。PD-1/VEGF双抗几乎是国内创新药跨境BD史上最热门的管线,形成了典型的in China for Global的格局。由于具备“免疫激活+抗血管生成”的协同抗肿瘤增效机制,PD-1/VEGF双抗被视为极有潜力迭代PD-1单抗的下一代疗法,是MNC扫货的重点管线。 在几个主要的PD-1/VEGF双抗管线背后,都已经站着MNC。
这笔交易之前,在PD-1/VEGF双抗的开发洪流中,RC148并不是最头部管线。作为全球首个获批上市的PD-1/VEGF双抗,康方生物的依沃西单抗(AK112)早已是全球领跑者。在头对头III期临床研究中,AK112甚至展现出优于前“药王”帕博利珠单抗的PFS数据。AK112的背后,站着Summit Therapeutics。2022年,双方达成总额50亿美元的BD交易,刷新了中国药企对外授权的记录,也点燃了全球制药界对这个赛道的热情。JPM 2026期间,Summit表示,已经向美国FDA递交上市申请,AK112的全球化进程再下一城。
此外,作为PD-1/VEGF双抗的第二梯队管线,三生制药的SSGJ-707、礼新医药的LM-299等明星管线也通过与MNC的合作,极大提升了开发效率。在AK112之后,与PD-1/VEGF管线相关的交易,都在刷新BD的金额记录。比如,2025年8月,三生制药的SSGJ-707以创纪录的12.5亿美元首付款授权给辉瑞,总交易额高达60亿美元,而礼新医药则将其LM-299授权给默沙东。这些由MNC重金加持的管线,凭借雄厚的资本和强大的全球临床开发能力,开发进程一再加速。
而临床进度主要集中于II期的RC148,在PD-1/VEGF第二梯队中不算亮眼。不过,RC148的临床数据十分亮眼。与艾伯维的这笔交易,可能会改变这种现状。重新变得充足的现金流,会扫清管线临床开发中的大多障碍,而艾伯维的药学、临床资源导入,将极大提升RC148临床开发的效率。而作为艾伯维合作方的荣昌生物,竞争身位也会应声而变。
专利悬崖倒逼,MNC重新审视中国创新药管线价值
在每年的JPM大会上,MNC会重点介绍未来一段时间的研发和商业化思路。到了2026年,应对即将到来的专利悬崖,成为MNC的策略重点。动脉网注意到,在应对专利悬崖的过程中,从中国创新药企授权的管线成为默沙东、再生元、武田制药等多家MNC的关键抓手。
科伦博泰,或将颠覆TROP2 ADC竞争格局。JPM 2026上,默沙东CEO Rob Davis在关于未来策略的论述中,多次提到sacituzumab tirumotecan(SKB264/MK-2870)。Rob Davis表示,在2025年,sacituzumab tirumotecan启动了多项III期临床研究,这些研究将自2027年起,陆续公布主要终点数据。
sacituzumab tirumotecan的原研药企是科伦博泰。2022年5月,科伦博泰将sacituzumab tirumotecan大中华区以外全球范围的独家开发、生产和商业化的权利授权,获得4700万美元的首付款,及总金额超13亿美元的开发、监管及商业化等里程碑付款等。这笔交易是国内ADC早期出海的标杆交易,授权3年多后,sacituzumab tirumotecan成为默沙东最重要的后期管线之一。
在默沙东的肿瘤产品线中,帕博利珠单抗的专利悬崖日益临近,寻找下一代增长引擎已是其最核心的战略任务。在这个过程中,作为能够与帕博利珠单抗联用的ADC,Sacituzumab tirumotecan被默沙东寄予厚望。现阶段,sacituzumab tirumotecan所在的TROP2 ADC领域,是最炙手可热的研发赛道之一。其中,吉利德的Trodelvy(戈沙妥珠单抗)、阿斯利康和第一三共合作开发的Datopotamab-deruxtecan等,是最头部的管线,领先优势明显。
作为全球首款获批的TROP2 ADC,戈沙妥珠单抗已经获批被用于三阴性乳腺癌、HR+/HER2-乳腺癌和尿路上皮癌等多个适应症,占据了先发优势和广阔的市场,而Datopotamab-deruxtecan凭借强大的DXd技术平台,拿下三阴性乳腺癌适应症,并在非小细胞肺癌等领域展现出“Best-in-class”的潜力,其在2023年ESMO大会上公布的肺癌研究数据,直接挑战了化疗的基石地位。
而随着Sacituzumab tirumotecan的多项III期临床实验在2025年启动,火热的TROP2 ADC市场出现了新的标量。作为后来者,借助默沙东强大的抗肿瘤药物临床开发经验,sacituzumab tirumotecan有了在垂直领域弯道超车的可能性。在这个过程中,保留了sacituzumab tirumotecan中国市场权益的科伦博泰,也由此获得了推动市场格局改变的力量。
翰森制药,重构肥胖、糖尿病用药市场。在JPM大会上,再生元将小分子GLP-1R激动剂Olatorepatide(HS-20094)列为其进军万亿级肥胖与糖尿病市场的关键布局。2025年6月,翰森制药与再生元达成Olatorepatide的授权合作,由此获得8000万美元首付款。这笔交易的总金额,可能高达19.3亿美元,翰森制药保留了Olatorepatide在中国市场的权益。
Olatorepatide是每周一次皮下注射的长效GLP - 1/GIP双受体激动剂,II期数据显示减重与降糖疗效可与司美格鲁肽媲美,且在肌肉保留、耐受性方面有潜在优势。BD交易前,翰森制药正在中国推进肥胖适应症III期试验,及2型糖尿病IIb期研究,计划2026年上半年公布肥胖III期关键数据。交易完成后,再生元计划2026年启动全球多中心III期试验,覆盖肥胖(含合并 2 型糖尿病人群)。
对于再生元而言,进入被诺和诺德、礼来围追堵截的肥胖和2型糖尿病领域,差异化策略是落子的关键,而Olatorepatide正是重要的抓手。再生元将Olatorepatide视为与自家抗体药物(如GPR75抗体)联用的核心组件,旨在探索“超越GLP-1”的减重疗效或更优的体重维持方案。
目前,全球肥胖与糖尿病市场由诺和诺德和礼来的多肽类注射药物绝对主导,口服剂型是所有后来者寻求突破的关键方向。
作为一款口服小分子药物,Olatorepatide天然具备优于注射剂的患者依从性,这是其挑战市场格局的最大潜力所在。早期临床数据中,Olatorepatide展现了良好的减重效果和安全性,具备成为“同类最佳”口服GLP-1R激动剂的潜力。其小分子特性使其成为理想的联合用药伙伴,为再生元探索多种创新组合疗法提供了灵活性。
当然,相比已经上市或处于III期临床后期的竞争对手,比如辉瑞、礼来的口服产品,Olatorepatide仍处于II期临床,可能不会颠覆2026年此类药品的市场格局。但Olatorepatide独特的联合用药思路,无疑会给这个市场带来新的重要变量。
信达生物,3年内输出2款重磅潜力新药。在JPM 2026,武田制药明确提出,2026年至2030年间,将推出至少8款具有突破性意义的重磅炸弹潜力药物。其中,有2款后期管线来自信达生物,即TAK-928(IBI363)和TAK-921(IBI343)。这让信达生物在JPM 2026上火了一把。
2025年10月,信达生物与武田制药达成总金额达114亿美元的交易,IBI363和IBI343的相关权益包含在内。其中,武田制药获得IBI363的全球共同开发和美国商业化权益,和IBI343大中华区外的独家授权。进入武田制药的管线体系后,IBI363和IBI343分别获得了新的编号TAK-928和TAK-921。从JPM 2026的分享看,这两个管线将成为武田制药未来在肿瘤领域的关键产品。
TAK-928是全球首创的PD-1/IL-2α偏向型双抗,聚焦PD-1耐药、冷肿瘤、PD-L1低表达肿瘤的治疗瓶颈,有望成为下一代免疫治疗的标杆。而TAK-921为CLDN18.2 ADC药物。而TAK-921所选择的抗体靶点CLDN18.2,是继HER2之后胃癌领域最受瞩目的“明星靶点”。
客观而言,TAK-928和TAK-921均处于热门的开发赛道。但与武田制药交易前,TAK-928和TAK-921的研发进度和临床数据在同行中都颇具竞争力。其中,TAK-928已启动二线治疗鳞状肺小细胞肺癌的全球III期临床实验,是全球首个进入III期临床的PD-1/IL-2α双抗;TAK-921已进入胃癌III期临床实验,胰腺癌I/II期临床实验,在这两个适应症中具有明显的差异化优势。
在获得武田制药的医学、临床资源加持后,这两款肿瘤新药具备了破局垂直领域治疗困境的可能。而在这个过程中,保留了TAK-928和TAK-921部分权益的信达生物,也将获得新的竞争力。
源头创新,中国创新药开始颠覆巨头市场
亚盛医药,挑战核心竞品的现有市场地位。亚盛医药上榜,原因与前述BD相关的创新药企不同,主要在于其自研产品利生妥(Lisaftoclax)的全球注册试验与适应症突破。在JPM 2026,亚盛医药创始人杨大俊提到,在2026年,利生妥将努力触达两项核心里程碑,包括GLORA-4试验(一线高危 MDS)多数入组完成,和利生妥纳入国家医保。这两项里程碑一旦达成,利生妥将挑战由罗氏、艾伯维联合开发的维奈克拉把控的现有市场。
2025年7月,利生妥在国内获批用于BTK 抑制剂失败的CLL/SLL(慢性淋巴细胞白血病/小淋巴细胞淋巴瘤),成果国内首个国产原研、全球第二款上市的Bcl-2抑制剂。而在此之前,作为全球首款上市的Bcl-2抑制剂,维奈克拉已经在2020年12月获批在国内用于部分机型髓系白血病、CLL和SLL。2023年3月起,维奈克拉被纳入国家医保,报销后的月治疗费用降至约3000元。
对于利生妥而言,找到差异化优势至关重要。杨大俊所提到的GLORA-4,是全球首个针对初治高危骨髓增生异常综合征(HR-MDS)的 Bcl-2 抑制剂注册III期试验。在过去近20年间,全球范围内均没有针对HR-MDS的靶向药获批。临床上,现有的HR-MDS治疗药物以去甲基化药物(HMAs)为主,但疗效十分有限,患者用药后的疾病客观缓解率(ORR)仅30%~40%、5年生存率仅 16-24%。
与此同时,作为全球首款获批上市的Bcl-2抑制剂,维奈克拉在HR-MDS的III期试验(VERONA)宣告失败,这让利生妥成为目前全球唯一推进该适应症注册III期的Bcl-2抑制剂。如果GLORA-4能够在2026 年完成多数入组,并且后续读出阳性数据,则利生妥有望在2027年至2028年间,成为全球首个获批一线HR-MDS的Bcl-2抑制剂,独占全球数十亿美元的未被满足市场,削弱维奈克拉在髓系肿瘤领域的优势。
当然,在JPM 2026期间,进入MNC新年策略的中国创新药企,远不止以上几家。而再鼎医药、三生制药、赞荣医药等,也凭借多条合作管线,成为MNC新年策略的重要组成部分,本文只是选择了其中最具代表性的部分。
不过,JPM 2026之上的亮眼表现,只是短暂的闪耀,到2026年末,这5家中国创新药企所在的细分市场格局能否被改变,还需要时间来验证。