上周五,FDA批准了强生公司旗下的小分子创新药Balversa(erdafitinib),治疗患有局部晚期或转移性膀胱癌的成人患者,他们具有FGFR3或FGFR2易感基因改变,并且在含铂化疗之前或之后疾病恶化。

Balversa曾被授予突破性疗法认定,同时获批的还有Qiagen开发的一款伴随诊断器械,用于检测FGFR2和FGFR3的突变。该器械将被用于选择具有FGFR2和FGFR3突变的患者,从而接受Balversa治疗。
“我们正处于更加个性化或精准医学的时代,将癌症治疗针对患者的特定基因突变或生物标志物的能力正在成为标准,并且在新的疾病类型中取得了进展。今天批准的代表第一个针对转移性膀胱癌患者的易感FGFR基因改变的个性化疗法,” FDA肿瘤卓越中心主任、FDA药物评估和研究中心血液学和肿瘤学产品办公室代理主任医师Richard Pazdur博士表示。“FGFR调节细胞生长、分裂、发育和组织修复过程中的重要过程。该药通过靶向FGFR的特定基因突变。“
膀胱癌是美国第六大常见癌症。最常见的膀胱癌类型是尿路上皮癌。膀胱癌与患者膀胱或尿路上皮(下泌尿道内层)中存在的基因突变有关。大约五分之一的复发性和难治性膀胱癌的患者中,出现了成纤维细胞生长因子受体(FGFR)改变。近年来,免疫疗法如默克公司的Keytruda和罗氏的Tecentriq已经成为转移性膀胱癌的标准治疗药物。
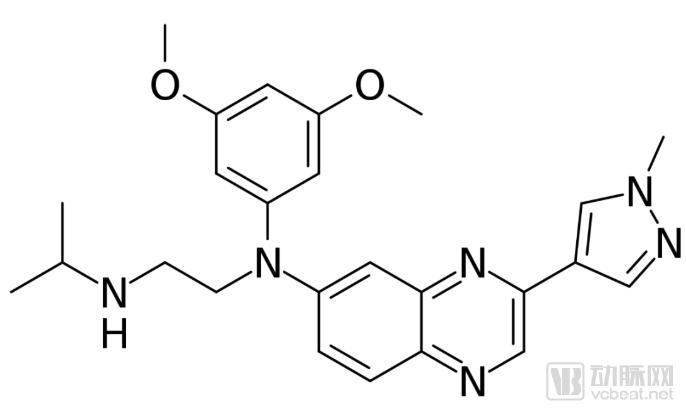
Balversa(erdafitinib)的分子式
Balversa的批准是基于在一项87名患者参加的临床试验中的表现。这些患者携带特定的FGFR2或FGFR3基因图表,总体缓解率为32.2%,其中2.3%具有完全缓解,近30%具有部分缓解,平均缓解时间大约为五个半月。该研究中约四分之一的患者之前接受过PD-L1/ PD-1治疗,这是针对局部晚期或转移性膀胱癌患者的标准治疗方法。
Balversa对先前对PD-L1/PD-1治疗无反应的患者亦有疗效。治疗也伴随着显著的副作用,包括严重眼部问题的风险,如角膜炎和视网膜疾病。FDA建议患者进行间歇性眼科检查。




























