
2019年4月22日-2019年4月27日,本周新药数据共14个,其中肿瘤4个,皮肤病3个,血液病和疼痛类各2个,肝病、传染病和骨科各1个。
●备受期待的吉利德NASH新药selonsertib第二项3期临床试验失败。此前业内认为首个NASH药物将诞生于Intercept公司的Ocaliva和吉利德公司的selonsertib之中,现在看来后者几无成功可能,吉利德也将希望寄于selonsertib、cilofexor及firsocostat的联合治疗临床试验。吉利德在NASH领域进行了豪赌,收购了一系列相关资产,但现在看结果不尽人意。
●Skyrizi(艾伯维,治疗银屑病)本周获批上市,Taltz(诺华,治疗非放射性轴性脊柱关节炎)即将提交NDA,这2个药物的靶点属于IL-23/IL-17信号通路,苏金单抗(诺华,治疗银屑病)的靶点也是如此。该通路与多种自身免疫炎症相关,多家药企正在积极研发。
●继Nivolumab/Ipilimumab去年获批一线治疗晚期肾细胞癌症后,第二款免疫检查点抑制剂组合疗法Keytruda/Inlyta获批一线治疗晚期肾细胞癌症。
●礼来软组织肉瘤药物Lartruvo上市后由于3期临床试验不理想,现在准备退出。该药物两年前获批,当时是40多年来首个批准的软组织肉瘤新药,2018年收入约为3.5亿美金。
FDA批准艾伯维的
Skyrizi(risankizumab)用于治疗银屑病
艾伯维(AbbVie)公司宣布,FDA批准其开发的IL-23特异性抑制剂Skyrizi(risankizumab)上市,用于治疗中重度银屑病。
该款新药是一款靶向IL-23的人源化单抗,能与IL-23的p19亚基结合并选择性的阻断IL-23信号通路。
本次获批基于包括四项三期临床试验在内的艾伯维全球银屑病临床试验。
Skyrizi能够显著清除皮肤症状,80%以上的患者接受治疗一年后90%皮肤症状消失,50%以上的患者患者皮肤症状完全消失。
FDA批准Bausch Health的Duobrii
用于治疗银屑病
本周,FDA批准了Bausch的银屑病治疗药物Duobrii上市申请,预计今年6月正式上市。
Duobrii是一款外用乳液,由0.01%的卤倍他索丙酸酯(halobetasol propionate)和0.045%的他扎罗汀(tazarotene)组成。
两项3期、多中心、随机、双盲临床试验评估了Duobrii在418名患者中的安全性和有效性。
接受Duobrii治疗的患者显著减轻了症状,且安全性在短期和长期均得到了验证。
FDA批准儿童红斑狼疮首个疗法
GSK治疗系统性红斑狼疮的Benlysta(Belimumab)获得FDA批准用于儿童患者,这是美国FDA批准的首款能够治疗儿童性红斑狼疮患者的疗法。该药物2011年获批用于治疗红斑狼疮。
Belimumab是一款人源化单抗,能够与B淋巴细胞刺激因子特异性结合以抑制B细胞。
93名红斑狼疮儿童患者入组接受了52周的Benlysta静脉注射治疗。
接受Benlysta与标准疗法治疗的儿童患者,相比接受安慰剂与标准疗法的患者,有更高比例得到了症状缓解,试验达到了临床终点。
美国首款严重疟疾药物获得突破性疗法认定
有望今年申请上市
美国La Jolla公司宣布旗下治疗严重疟疾的在研药物LJPC-0118获得了突破性疗法认定。
LJPC-0118是一种专利化合物,具有未公开的作用机制。
LJPC-0119开展了两项随机、设置对照组的临床试验。
在治疗严重的恶性疟原虫疟疾时,LJPC-0118的活性成分展现出了比奎宁更好的效果,有效减少了患者的死亡率。
礼来IL-17A拮抗剂取得积极3期临床结果
计划今年提交监管申请
礼来旗下治疗非放射性轴性脊柱关节炎(nr-axSpA)的IL-17A抑制剂Taltz(ixekizumab)在3期临床中达到了主要终点,礼来有望在今年向FDA提交监管申请。如若获批,这将成为第一款治疗nr-axSpA的IL-17A拮抗剂。
Taltz是一款抗IL-17A单抗。
开放标签、单臂、单剂量的多中心临床试验。共计22名患者接受治疗。
22名接受治疗的患者中21名存活并且无不良事件,同时患者的运动能力较基线有所提高。
IL-23/IL-17 信号通路与多种自身免疫疾病相关
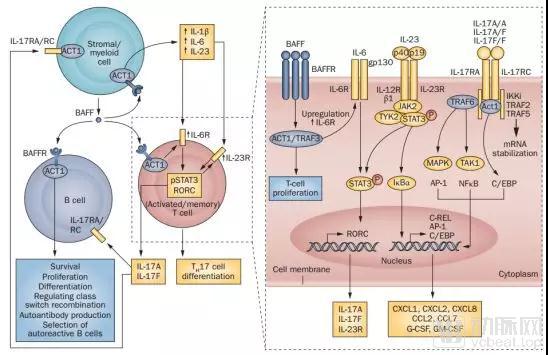
数据来源:nature review
Autolus CD19/CD22双靶点CAR-T疗法
获得FDA孤儿药认定
FDA近日授予了Autolus Therapeutics的CD19/CD22靶点CAR-T疗法AUTO3孤儿药称号,该疗法用于治疗急性淋巴细胞白血病(ALL)。该疗法有望成为治疗儿童ALL的最佳疗法。
AUTO3含有两种嵌合抗原受体,两种受体独立靶向CD19及CD22。
本次批准基于临床1/2期的试验数据。
实验结果显示,该疗法能够更好的解决抗原逃逸问题,并体现了优于其他CAR-T疗法的安全性。
CRISPR Therapeutics造血干细胞疗法获FDA
治疗输血依赖性β地中海贫血快速通道资格
CRISPR Therapeutics和Vetex宣布,两家公司合作的CTX001疗法获得了FDA授予的治疗输血依赖性β地中海贫血的快速通道资格。
CTX001是一款利用CRISPR/Cas9基因编辑的自体造血干细胞疗法。
一项开放标签的I/II期临床试验将评估18-35岁输血依赖性β地贫非β0/β0亚型患者接受单剂量CTX001治疗的安全性和有效性。首例患者在今年2月接受了治疗。
试验在进行中。
K药联合Inlyta组合疗法
获批一线治疗晚期肾细胞癌
FDA宣布批准默沙东的Keytruda联合Inlyta(axitinib)组合疗法一线治疗晚期肾细胞癌(RCC)。
Keytruda是一款抗PD-1单抗。Inlyta是辉瑞开发的酪氨酸激酶抑制剂(TKI)。
本次获批基于名为KEYNOTE-426的随机、双盲、活性对照3期临床试验。共计861名晚期肾细胞癌症患者随机分为两组接受治疗。
接受Keytruda/Inlyta组合疗法的患者显示出更长的无进展生存期(15.1个月vs 11.1个月),中期分析显示该组合疗法将患者的死亡风险降低了47%。
礼来与信达合作研发的PD-1/PD-L1双抗IB1318
中国1期临床完成首例患者给药
信达宣布其与礼来合作研发的PD-1/PD-L1双抗IB1318完成中国的1期临床首例患者给药。这是全球首个进入临床的PD-1/PD-L1双抗。
IB1318通过桥接表达PD-1的T细胞和表达PD-L1的肿瘤细胞,同时阻断两者的信号通路。
在中国启动的1期临床试验CIBI318A101将用于评估单药在受试者中的安全性、耐受性及抗肿瘤活性。
临床试验进行中。
新型三阴性乳腺癌免疫疗法
INT230-6获得FDA快速通道资格
Intensity Therapeutics利用其DfuseExSM技术平台开发的新型免疫药物注射剂INT230-6已获得FDA授予的快速通道资格。
INT230-6由两种有效抗癌剂和一种渗透增强分子组成,药物借由专有技术可迅速分散并渗透到癌细胞中。
Intensity正在进行该药物的1/2期临床研究(NCT0358289)。
临床前研究显示,采用INT230-6体内模型治疗严重癌症可显著提高总生存率。
吉利德NASH新药Selonsertib
遭遇第二个3期临床失败
吉利德近日公布,其治疗非酒精性脂肪性肝炎(NASH)的药物Selonsertib未达到第二项3期试验Stella-3的主要终点。今年2月,Selonsertib错过了首个3期研究的一级终点。
Selonsertib是一款ASK小分子抑制剂。ASK 1是一种促炎症反应和表面纤维化的酶。
Stella-3是一项随机、双盲、安慰剂对照的3期临床试验。主要终点包括在48周时NASH CRN分类≥1期的纤维化改善且无NASH恶化的患者比例,以及在240周时患者的无事件生存率。
对802名患者的研究显示,每天服用6mg或18mg selonsertib的患者中,在48周时至少一阶段改善纤维化而不恶化NASH的比例分别为12.1%和9.3%,两组结果均未能达到安慰剂组的13.2%。
NASH是全球最常见的慢性肝病,尚没有特效药物,目前进入临床实验阶段药物的机理主要是抗代谢、抗氧化和抗纤维化。
NASH现有的主要治疗靶点和通路
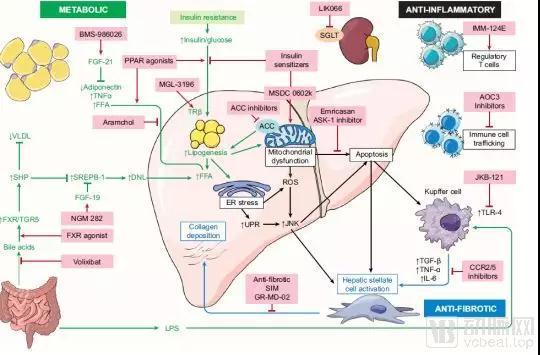
数据来源:Journal of hepatology
礼来软组织肉瘤药物Lartruvo
由于上市后临床试验不理想开始撤市
礼来宣布旗下软组织肉瘤药物Lartruvo(Olaratumab)在上市两年半后开始撤市工作。在Lartruvo的上市后大型3期临床实验ANNOUNCE中,该药物在全部治疗人群中未能显示出生存期获益。该药物此前于2016年10月获批,是40多年来FDA批准的首个软组织肉瘤治疗药物。2018年Lartruvo的全球销售收入是3.05亿美元。
Olaratumab是一种靶向血小板衍生生长因子受体PDGFR的单抗药物。
ANNOUNCE试验是一项随机、双盲的3期Lartruvo联合多柔比星的临床研究。
Lartruvo联合多柔比星比多柔比星单独使用未能延长软组织肉瘤患者生存期(20.4个月vs 19.7个月),在中位无进展生存时间上甚至逊于多柔比星单药(5.4个月vs 6.8个月)。
Teva暂停Ajovy丛集性头痛临床研究
由于实验结果分析显示治疗期内,用于治疗丛集性疼痛的Ajovy(fremanezumab)不太可能达到主要终点,Teva决定停止Ajovy的该项治疗丛集性头痛的临床开发计划。
Teva是全球第二款获批上市的降钙素基因相关肽(CGRP)单抗,2018年9月获批用于成人偏头痛的预防性治疗。
研究计划的暂停主要基于针对阵发性丛集性头痛的3期临床试验ENFORCE研究。
无效性分析显示,该药物在4周治疗期间内,到达减少每周丛集性头痛平均发作次数与基线平均变化的主要终点的可能性很小。
辉瑞/礼来公布抗NGF类新药
Tanezumab3期临床结果,前景堪忧
辉瑞、礼来联合开发的非阿片类新型止痛药tanezumab近日公布了3期临床研究的顶线结果,结果不尽如人意。
Tanezumab是一种人源化、靶向结合并一直神经生长因子(NGF)的单抗药物。
该临床实验A4091058是一项随机、双盲、阳性药物对照、多中心的平行组研究,入组的中重度患者分别接受Tanezumab皮下注射或口服NSAID,共进行56周的治疗。
仅高剂量tanezumab表现出显著疗效,但同时关节安全事件发生率明显升高,出现的安全问题与此前对NGF抑制剂的研究结果一致。

●礼来宣布和Avidity Biosience合作,利用Avidity的抗体偶练寡核苷酸技术平台合作开发RNA疗法。该平台较传统技术具有更好的药代动力学及生物分布特性,并且可避免脂质体递送寡核苷酸带来的毒副作用。
●复宏汉霖宣布旗下生物类似药曲妥珠单抗HLX02申请上市,这是国内首个按照2015年《生物类似药研发与评价技术指导原则(试行)》以与原研头对头国际多中心III期临床试验标准申报上市的曲妥珠单抗。罗氏曲妥珠单抗至今全球上市21年,2018年全球销售额68.48亿美元,中国销售额约27亿人民币。
●豪森宣布其1类新药甲磺酸奥美替尼国内已申报上市,用于EGFR T790M耐药突变的局部晚期或转移性非小细胞肺癌的患者治疗。这是艾维替尼申报上市后的第二款三代EGFR-TKI。
●恒瑞宣布慢性肾病贫血新药DDO-3055获批临床,该药物用于治疗慢性肾病导致的贫血,对标药物为罗沙司他。截至目前,恒瑞对DDO-3055已投入研发费用约为1310万元。
●礼来宣布将中国销售的两款抗生素希刻劳(Ceclor)和稳可信(Vanocin),及苏州的希刻劳生产工厂以3.75亿美金售价出售给亿腾医药,本次交易预计在2019年下半年或2020年初完成。今后礼来将把重心更多的聚集在中国创新药开发上。
●科望医药近日宣布与美国Bio-Techne公司达成战略合作,将利用Bio-Techne的抗体库进行创新抗肿瘤免疫抗体药物的研发。
●Fulcrum Therapeutics公司宣布以不超过10%的股权购入GSK此前实验失败的心血管药物Losmapimod的全球权益,Fulcrum公司将继续探索该药物在治疗罕见病面肩肱型肌营养不良症(FSHD)的可能性。
































