
本周新药数据共8个,其中5个肿瘤,1个疫苗,1个眼科,1个CNS
❖BMS宣布FDA批准Zeposia (ozanimod) 上市,每日1次口服0.92mg用于治疗成人复发型多发性硬化症(RMS)。Ozanimod也是一个有故事的产品,最早是由receptors开发,2015年被新基以72亿美元收购。2018年FDA以这个产品的NDA申请材料中部分材料存在空白为由拒绝新基的申请,引起轩然大波。后续研究发现Ozanimod在临床试验中发现一个代谢产物半衰期超长,在人体长达10-13天,远高于Ozanimod的19小时,可能会出现蓄积风险,当时在新基内部还诱发了各种甩锅。该活性代谢物事件最终导致ozanimod的上市推迟2年,但现在RMS的市场已经比较拥挤,ozanimod若想后续翻身,可能得需要拓展其他自免适应症了。
❖德国默克宣布,日本批准其tepotinib治疗携带MET外显子14跳跃突变的晚期NSCLC患者,tepotinib是全球第一款获批用于治疗携带MET基因突变的晚期NSCLC患者的口服MET抑制剂。cMet是个与EGFR类似的受体激酶,胞外区与生长因子配体HGF 结合后诱导二聚从而传递增长信号,若cMet的特定蛋白缺失会让这个受体长期处于激活状态,会引起细胞生长失控,目前没有针对这个药物的特效药物。目前行业内主要是tepotinib与诺华的capmatinib在竞争,后者已经获得FDA优先审批资格、有望率先在美国上市。但 tepotinib 似乎选择性更好,无论四级以上副作用比例还是因毒性退组患者人数都低于capmatinib。目前国内尚无biotech在这个领域进行深入布局
艾伯维和基因泰克公司宣布,双方联合开发的Venclexta与低甲基化剂azacitidine联合,在治疗急性髓系白血病(AML)患者的3期临床试验VIALE-A(M15-656)中,达到了双重主要临床终点
Venclexta是靶向药物,它能够与BCL-2蛋白特异性结合并且抑制其功能
VIALE-A试验是一项随机、双盲、含安慰剂对照组的3期临床研究,旨在评估Venclexta与azacitidine联合,在治疗443名AML患者中的安全性与疗效
VIALE-A试验是一项随机、双盲、含安慰剂对照组的3期临床研究,旨在评估Venclexta与azacitidine联合,在治疗443名AML患者中的安全性与疗效
Novavax公司宣布,其重组四价季节性流感疫苗NanoFlu,在预防65岁及以上老年人感染流感的关键性3期临床试验中,达到了所有主要终点
NanoFlu是Novavax公司利用其SF9昆虫细胞杆状病毒系统中生产的重组血凝素(HA)蛋白纳米颗粒流感疫苗。它含有该公司专有的基于皂苷的Matrix-M佐剂
这项3期临床试验共招募了2652名健康的老年人,在分别接种NanoFlu或已上市的流感疫苗Fluzone Quadrivalent后进行为期1年的随访,并对他们第28天的血清样本进行免疫原性分析。
该试验达到了所有主要终点。与活性对照组相比,NanoFlu的免疫原性和安全性达到了非劣效性标准
德国默克宣布,日本批准其tepotinib治疗携带MET外显子14跳跃突变的晚期非小细胞肺癌(NSCLC)患者。tepotinib是全球第一款获批用于治疗携带MET基因突变的晚期NSCLC患者的口服MET抑制剂
Tepmetko在MET过度表达或扩增的NSCLC患者中显示出抗肿瘤活性。除了在治疗NSCLC患者的临床试验中得到应用,tepotinib也在2期临床试验中治疗肝细胞癌患者
在Tepmetko名为VISION的2期临床试验中,经过组织活检或液体活检确认的携带MET外显子14跳跃突变的99名转移性NSCLC患者参与该试验。
试验数据表明,Tepmetko可能改善这些患者的治疗选择。经独立评审委员会(IRC)评估的患者总缓解率(ORR)为42.4%,患者的中位缓解持续时间(DOR)均为12.4个月
NSCLC的驱动突变
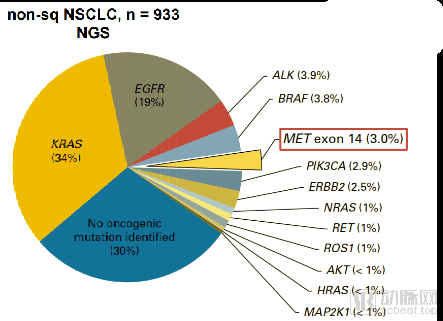
数据来源:merck
第一三共和阿斯利康公司宣布,ADC-DS8201在治疗先前接受过治疗的HER2过度表达癌症患者的1期临床试验中,将55.6%的非小细胞肺癌(NSCLC)患者的肿瘤缩小
Enhertu利用了第一三共特有的ADC技术,将人源HER2抗体曲妥珠单抗通过四肽接头与一种新型拓扑异构酶1抑制剂链接,靶向癌细胞,并将药物递送至细胞内部
共有60名经治HER2过度表达或突变的癌症患者参与该项1期临床研究,其中包括18名NSCLC患者、20名CRC患者,和其他几名不同肿瘤类型的患者。
NSCLC患者的客观缓解率最高,其中55.6%的患者肿瘤被缩小,中位缓解时间达到10.7个月。在携带HER2突变的NSCLC患者中的疗效更为明显,Enhertu的治疗使该组中72.7%的患者得到缓解
小野制药宣布,其BTK抑制剂Velexbru(tirabrutinib hydrochloride)在日本已获得批准,用于治疗复发或难治性原发性中枢神经系统淋巴瘤(PCNSL)患者
Velexbru是由小野制药开发的一种高选择性口服BTK抑制剂,在日本已被开发用于治疗B细胞肿瘤和自身免疫性疾病。
该结果是基于一项多中心、开放标签的1/2期临床研究
根据独立审查委员会的评估,在空腹服用每日一次480 mg Velexbru治疗的17例患者中,患者的总缓解率(ORR)达到52.9%。
VBL Therapeutics公司宣布,其基因疗法VB-111,在治疗对铂类药物产生耐药性的卵巢癌患者的关键性3期临床试验OVAL中,取得积极的中期分析结果
VB-111是为治疗多种实体瘤而开发的“first-in-class”基因疗法。它使用双重机制靶向实体。它通过腺病毒载体,在肿瘤组织中增生的血管内皮细胞中表达一种TNF受体和Fas构成的融合蛋白
OVAL研究是一项双盲,含对照组的关键性3期研究。该试验比较了VB-111联合紫杉醇,与安慰剂加紫杉醇的联合疗法相比,治疗对铂类药物产生耐药性的卵巢癌患者的疗效
试验数据显示,前60名可评估患者中,CA-125蛋白水平得到缓解的患者总缓解率为53%。在接受治疗后出现发烧症状的患者中,缓解率达到69%,治疗后发烧是VB-111治疗的一个常见反应。
BMS宣布FDA批准Zeposia (ozanimod) 上市,每日1次口服0.92mg用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征、复发缓解型多发性硬化症(RRMS)、以及活动性继发进展型多发性硬化症(SPMS)
Zeposia是目前唯一一个在处方前不需要基因检测、也不需要在首次给药后按照标签监测健康状况的鞘氨醇1-磷酸受体(S1PR)调节剂
FDA此项批准主要基于目前为止在复发型MS患者中开展的最大规模“头对头”关键III期SUNBEAM研究(n=1346)和RADIANCE研究B部分(n=1320)的数据,共涉及超过2600例成人患者。
两项研究均证明,每日1次口服Zeposia在年化复发率(ARR)、脑损伤病灶数量和大小均优于每周注射1次Avonex(干扰素β-1a)
S1PR药物的作用机制
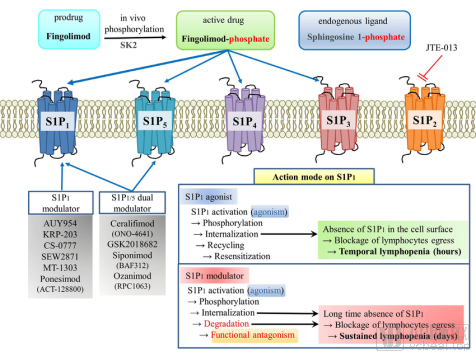
数据来源:celgene
Bayer Yakuhin与Santen制药近日联合宣布,Eylea(aflibercept,阿柏西普)在日本获批一个新的适应症,用于治疗新生血管性青光眼(NVG)
阿柏西普是人血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)受体1和受体2胞外区结合域与人免疫球蛋白Fc段重组形成的融合蛋白,是一种新的抗VEGF药物
基于两项III期研究的数据:随机、双盲、对照VEGA研究,开放标签、单臂VENERA研究。这两项研究调查了日本NVG患者玻璃体腔注射Eylea的疗效、安全性和耐受性。
两项研究均证实了Eylea的疗效,达到了治疗第1周眼压相对基线显著降低的主要终点、也达到了第1周虹膜新生血管(NVI)评分相对基线显著改善的次要终点
❖拜耳(Bayer)与印度的Curadev公司宣布达成一项研究合作和许可协议,开发新型干扰素基因刺激蛋白(stimulator of inteferon gene, STING)拮抗剂,治疗肺部疾病、心血管疾病和其它炎症性疾病患者。激活STING信号通路的激动剂是癌症免疫学研发的热点之一,不过目前在研STING激动剂在临床试验中还没有产生显著的效果
❖诺诚健华(InnoCare Pharma)正式在港交所挂牌上市,敲钟仪式同日举办,此次诺诚健华根据港交所主板上市规则第十八A章上市,是2020年以来首家登陆港股市场的生物医药公司。公司目前管线内有九项候选药物,其中Leading compound是奥布替尼(BTK)。
❖南新制药正式在科创板挂牌上市,拟募集资金12.23亿元。南新制药选择以科创板第一套标准上市,2018年、2019年公司营业总收入分别为7.00亿元、10.14亿元。同期净利润分别为0.48亿元、0.88亿元,累计净利润为1.36亿元。公司上市时市盈率为55.48倍,预计估值48.92亿
❖赛诺菲疫苗的全球业务部门赛诺菲巴斯德和临床阶段mRNA治疗公司Translate Bio(Nasdaq:TBIO)将合作开发用于COVID-19的新型mRNA疫苗,2018年Translate Bio与赛诺菲巴斯德签订独家合作许可协议,以开发针对多达5种传染病病原体的mRNA疫苗




























