近日,华海药业子公司赛斯尔擎基于自研非病毒DNA技术平台的CAR-T产品CG105,在IIT试验中治疗多发性骨髓瘤疗效显著,完成回输的3例中,已观察到2例完全缓解(CR)和1例严格完全缓解(SCR),且安全性高,未观测到 ICANs,该产品即将推进IND申报。
2019年,深耕细胞治疗研发三十余年、曾任海外上市Biotech细胞工程总监的李林红博士应华海药业邀请回国,和公司董事长朱向阳博士一道,创立赛斯尔擎生物技术(上海)有限公司,在“非病毒基因递送平台”关键技术上取得了突破,并在临床上得到了验证。
针对目前市场上“百万天价”的细胞治疗产品,以及围绕这些产品的生产便捷性、生产周期、产能限制、致瘤风险等的讨论,如何从“源头”解决这些问题,从载体技术角度进行的创新是否可以解决这些问题,是否可以将这些新疗法让普通大众可以负担得起?递送创新将为CAR-T疗法带来哪些新的可能性?动脉网和赛斯尔擎CEO、首席科学家李林红博士聊了聊。

李林红博士师从S. W. Hui博士,Roswell Park Cancer Institute生物物理系博士毕业。加入专门从事非病毒细胞治疗技术的MaxCyte19年。带领细胞工程部门进行非病毒生物技术研究和开发。与团队一起,帮助创新公司MaxCyte成功上市。
1电转DNA关键创新,破解非病毒载体效率难题
事实上,追溯到早期体外CAR-T探索,非病毒载体递送和病毒载体递送技术同为非常关键的路径,非病毒通过转座子、电穿孔、脂质纳米颗粒等非病毒手段将CAR基因导入T细胞,以期规避病毒载体潜在的免疫原性、插入突变风险及高昂生产成本。然而,非病毒DNA递送在效率方面存在瓶颈,业界也一直未能突破此瓶颈,由此病毒载体(如慢病毒、γ-逆转录病毒)更快获得临床验证,成为当之无愧的主流产品路径。
而赛斯尔擎则延续李林红博士数十年在该领域的积累,聚焦于非病毒递送技术的持续研发。非病毒递送的核心电转DNA(电穿孔介导DNA递送)是一种典型的非病毒物理递送方式,通过短时高压电脉冲在细胞膜上形成瞬时纳米孔,使外源DNA直接进入细胞质,从而实现高效、快速、无病毒的基因递送。
赛斯尔擎团队的“非病毒DNA定位递送平台”,经过优化指令结构、工艺升级、细胞因子平衡使用等多方面的综合升级,工业上实现了非病毒DNA的定点插入,进一步提升了体内T细胞靶向转染的精准度与通量,实现CAR的表达,同时极大降低了插入突变风险。
基于扎实的研发基础,赛斯尔擎非病毒DNA定位递送平台已突破关键技术,在核心的疗效提升方面取得进展——在核心管线之一,治疗多发性骨髓瘤的IIT试验中,CG105产品疗效显著,在至今已回输的3例患者,观察到2例完全缓解(CR)和1例严格完全缓解(SCR)的人体有效性数据;在动物实验中观察到比肩病毒载体CAR-T的体内效果。
2成本降低50%~80%,非病毒载体切中规模化制备痛点
在最为关键的技术开发和疗效数据上取得突破后,“赛斯尔擎的首要目标是,把成本降下来,让更多患者用得起、用得好。”李林红博士谈到。开发新型递送系统的另一核心问题在于规模化生产能力和成本控制能力,尤其是CMC、临床转化的可行性。不解决病毒规模化生产或非病毒替代,CAR-T就难以下沉至二线/一线甚至门诊治疗。
病毒递送的成本前期主要集中在病毒载体研发及产能上。当前,病毒产能扩大痛点逐步解决,更核心问题在于制备工艺的复杂性,以及由此带来的配套资源成本。而赛斯尔擎非病毒载体平台因极大的工艺便捷性、高效的临床开发周期,可以大幅降低配套成本。
制备上,电穿孔技术操作简单、快速,均一性高,已完成超30批次临床产品制备。且电转后的T细胞可直接在普通培养基中扩增,无需特殊培养体系,制备成本大幅降低,非病毒载体的价格优势将被进一步放大。
远期来看,非病毒载体平台的工艺便捷性与低成本、低产能壁垒,将为后续向通用型CAR-T拓展筑牢地基。
3“黑框警告”阴影下,CAR-T如何打开自免、慢病市场?
此前,FDA对全部已上市 BCMA/CD19 靶向自体CAR-T细胞产品发出“黑框警告”,根本原因是逆转录病毒/慢病毒介导的CAR转基因整合位点多,具有近乎随机性的不可控特点,一旦插入位点落在原癌基因、抑癌基因或关键调控元件附近,即可通过插入突变激活致癌通路,导致转基因阳性的T 细胞恶性肿瘤。该风险虽总体发生率低,但可在回输后数周至数年出现,并可致死,故要求终身监测。
“成瘤风险背后的安全性隐忧,对CAR-T向自免、慢性病领域的拓展造成了一定的阻碍。”李林红博士说,而非病毒载体定位整合优异的安全性,则有望颠覆这一范式。以赛斯尔擎电转DNA路径来看,通过非病毒DNA贡体的定点插入,直接定位整合至指定位点,脱靶点少,安全性优异,提升产品的应用场景与临床监测要求。
凭借成本与安全性的突破,非病毒载体在开发与制备上具有快速、高效的特点。李林红博士提到,自有非病毒DNA定位递送平台最快可在6个月内完成设计-动物药效-急性安评-生产CMC的早期研发,推进IIT人体试验。这意味着,平台化优势与可复制经验能够进一步放大,在后续适应症拓展、管线布局探索上将大放异彩。
李林红博士指出,根据CAR-T临床应用及特征数据,核心产品CG105为自体CAR-T产品,平均8天内即可提取足够患者抗体细胞进行定制。其非病毒DNA平台将先在血液瘤上快速验证疗效,后再推进实体瘤及通用型管线。
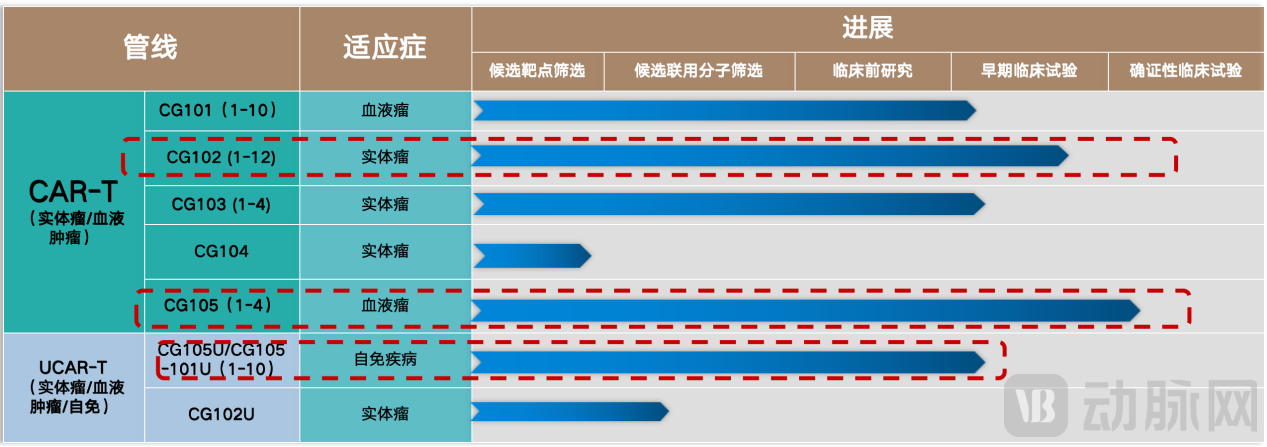
从CAR-T拓展来看,不同载体技术可能会契合不同的适应症,无论是肿瘤、自免、慢性病或是抗病毒、抗纤维化、抗衰老等多种匹配方向,打开多元的商业化前景。
技术路径与治疗方案没有恒定不变的标准答案。新一代技术方案不断诞生,却不会否定现有技术的价值,而是将携手拓宽赛道的想象空间。最终,技术先进性、量产落地与成本控制将共同组建成一种新兴CAR-T方案,切实造福患者。未来如何,我们拭目以待。





























