前言
2017年8月,美国FDA批准全球首款免疫细胞治疗CAR-T产品Kymriah,用于治疗25岁以下复发或难治性B细胞急性淋巴细胞白血病,且于2018年新增适应症成人复发或难治性弥漫性大B细胞淋巴瘤,迅速点燃了该领域的热情。随着2021年,中国NMPA连续批准复星凯特和药明巨诺的两款CAR-T产品上市,以及2022年,南京传奇生物用于治疗成人复发或难治性多发性骨髓瘤的产品Carvykti相继获得美国、欧盟批准上市,进一步加速了免疫细胞治疗领域的研发进程。纵览免疫细胞治疗的发展历程,CAR-T、TCR-T、CAR-NK、TIL等多种技术路径竞相发力,各显神通。
基于此,蛋壳研究院撰写了《2022免疫细胞治疗行业报告》,并在系列报告(一)中着重回答以下几个问题:
1、免疫细胞治疗的研发现状及发展的成熟度如何?
2、各类免疫细胞治疗的杀瘤机制是什么,主要应对哪些适应症?
3、当前免疫细胞治疗面临的核心瓶颈及突围思路是什么?
4、从安全性、有效性、耐久性及商业化维度,全面评价各类技术路径的发展前景如何?
为了弄清上述问题,蛋壳研究院在产业内进行了广泛的调研,并结合自己的研究内容,试图从行业概述、技术路径、发展机遇与挑战、未来趋势研判等维度全面解析免疫细胞治疗行业,以期为行业关注者及参与者提供有价值的行业信息。本篇报告主要聚焦于技术路径视角,后续系列报告将重点展开生产工艺维度的探讨。
(注:获取本报告全文,请扫描文末二维码)
免疫细胞治疗“活药物”疗效凸显,全球研发热度不减
1.1 免疫细胞治疗——肿瘤免疫疗法中的“活药物”,疗效优势凸显
■ 免疫细胞治疗
过继性免疫治疗(Adoptive Cell Transfer Therapy, ACT),通常是指从肿瘤患者体内/异体采集、分离出免疫细胞,经体外扩增培养、筛选鉴定,再回输患者体内,从而加强识别并杀伤肿瘤细胞,治疗恶性肿瘤。
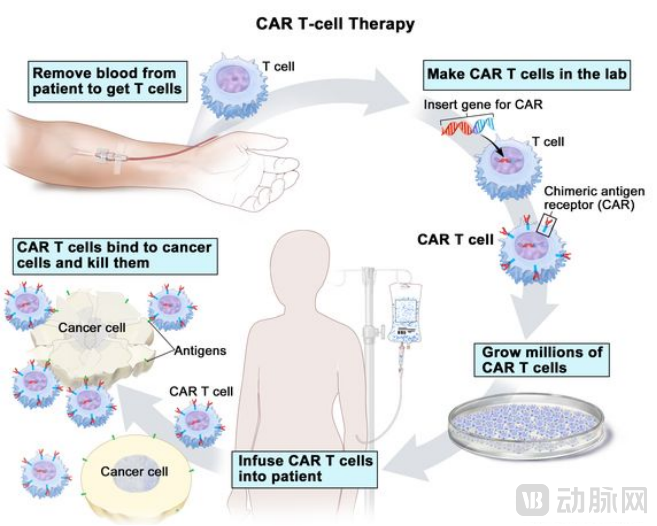
资料来源:National Cancer Institute,蛋壳研究院
根据是否经基因工程改造分类。经基因改造:由两个结构组成,分别提供靶向性+杀伤性,常见CAR-T、TCR-T、CAR-NK、CAR-M等,体外基因改造让免疫细胞获得对肿瘤细胞的特异性识别能力(靶向性),再回输患者体内,从而起到特异性杀伤肿瘤细胞的功能(杀伤性)。未经改造:常见TIL、LAK、CIK、DC、NK、Treg、CTL、γδT等。
根据细胞来源分类。自体型:从患者自身分离的免疫细胞,“1v1”个性化服务,成本高,等待周期长。通用型:供者捐献,“1v多”现货即用型,成本低。
■ 适应症
恶性肿瘤的末线治疗(未来可能前移),包括血液瘤&实体瘤。
■ 优势
成药性:相比于传统药物基于蛋白质层面的研发,避开不可成药靶点(e.g. CAR-T是用病毒载体携带CAR基因转导到T细胞即可表达CAR蛋白)。
疗效佳:抗体药PD-1/PD-L1的客观缓解率ORR普遍不理想,通常在10-30%。FDA获批的数款CAR-T的ORR普遍在70-90%,且对于PD-1耐药的患者,根据TIL领头羊Iovance公司在2021年美国临床肿瘤学会年会(ASCO)披露LN-144治疗末线黑色素瘤的ORR达36%。
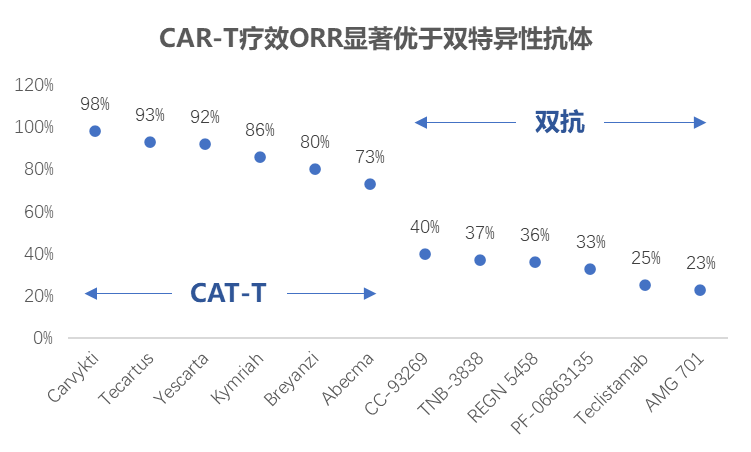
资料来源:公开信息,蛋壳研究院梳理
■ 治疗流程(自体为例)
采集患者外周血并分离T细胞——通过基因工程将提前设计好的CAR基因导入T细胞——筛选成功在细胞表面表达CAR蛋白的CAR-T细胞——体外扩增培养——回输患者杀瘤并严密监控。
■ 本报告重点讨论
常见的免疫细胞疗法包括CAR-T、TCR-T、CAR-NK、TIL。其中CAR-T的发展最为成熟,全球已有8款产品获批上市(FDA批准6款,国内2款license in),在血液瘤方面疗效显著。
1.2 第一代CAR克服TCR的MHC限制性,各代CAR旨在加强细胞的增殖及杀伤力
第一代CAR来源于对TCR的改进,摆脱MHC限制性
TCR(T细胞受体):MHC限制性。TCR属于免疫球蛋白家族,由α链和β链通过二硫键形成异二聚体。TCR的胞外结构与抗体的Fab段高度相似,不同之处在于,抗体可变区能直接结合抗原,但TCR可变区只能结合与MHC形成复合体的抗原。然而,肿瘤细胞会调低MHC I分子表达从而逃逸免疫系统的识别。
第一代CAR(嵌合抗原受体):非MHC限制性。为了克服TCR的MHC限制,1989年,以色列科学家Zelig Eshhar团队将TCR可变区替换为抗体可变区,构建出抗体可变区+TCR恒定区的嵌合受体,并证明该嵌合受体可直接结合抗原。1993年,第一代CAR产生:科学家对抗体可变区和TCR恒定区均进行简化构建,将TCR胞外区替换为单链抗体scFv(因为抗体重链和轻链的可变区人为偶联后形成的单链抗体scFv和抗体的Fab区一样具备识别抗原的功能),并将单链抗体scFv直接与激活受体CD3ζ融合成一个蛋白质(因为TCR激活后与CD3形成非共价复合体并通过CD3ζ亚基将细胞外信号传导到细胞内),并证明了其体外特异性杀伤肿瘤的能力。
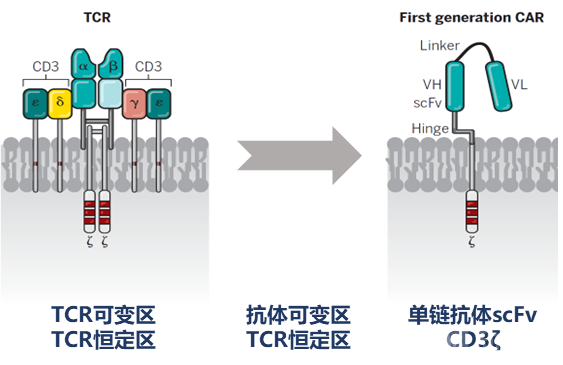
资料来源:Science,蛋壳研究院
CAR的核心结构——胞外抗原结合域&胞内信号传导域
胞外抗原结合域:提供靶向性,特异性识别肿瘤相关抗原。即单链可变片段scFv,由抗原特异性免疫球蛋白的可变重链VH、可变轻链VL组成。例如,急性淋巴细胞白血病患者肿瘤细胞表面表达CD19,构建的CAR蛋白的scFv可识别CD19,从而活化T细胞,杀伤肿瘤细胞。
胞内信号传导域:决定免疫细胞的增殖活化和杀伤能力。第一代CAR的基础组件是CD3ζ,随着迭代优化,增加共刺激分子、细胞因子等,进一步强化免疫细胞的能力。
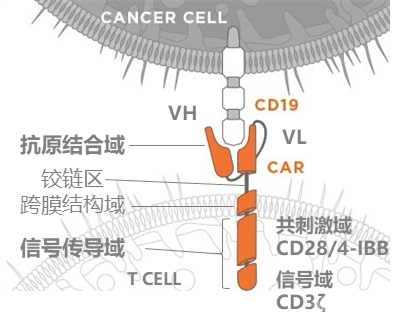
资料来源:公开信息,蛋壳研究院
各代CAR结构的优化基于胞内共刺激域,加强增殖活化杀伤力
第一代:只含激活受体CD3-ζ。细胞无法完全活化,扩增慢/持久性差/抗肿瘤效果弱。
第二代:1个共刺激分子,CD28或4-IBB。增强T细胞的增殖,延长存活时间。
第三代:2个共刺激分子,CD28和4-IBB。进一步增强T细胞的增殖和活化。
第四代:促炎症细胞因子IL-12。募集NK等天然杀伤细胞,增强T细胞的杀伤力。
第五代:细胞质IL-2Rβ链结构域,带有STAT3/5的结合位点。克服肿瘤抑制微环境,提高T细胞抗肿瘤效果。
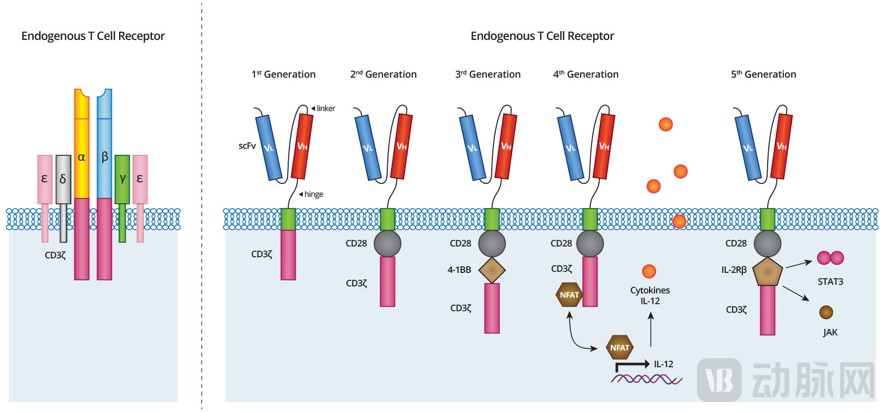
资料来源:BJC,蛋壳研究院
1.3 发展历程:CAR-T后来居上,血液瘤疗效显著,屡获FDA批准
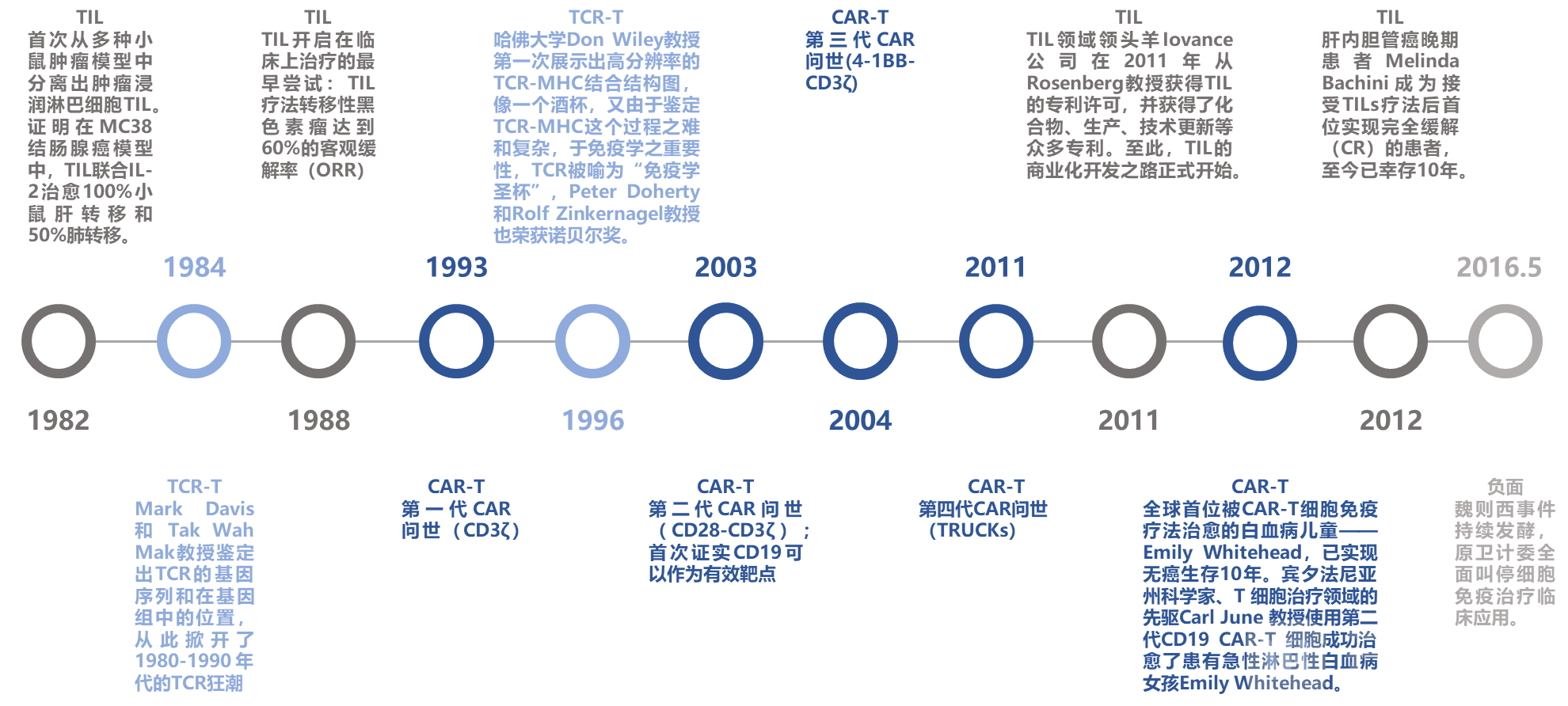
纵览免疫细胞治疗的发展历程,我们发现,第一代CAR在1993年才由TCR改造而来,相比于TCR和TIL,起步较晚,但以血液瘤疗效显著,2017年后多款产品相继获批。但TCR和TIL主攻实体瘤,治疗难度大。下述列示免疫细胞治疗领域的关键节点及事件。
1982年,先驱StevenRosenberg博士和美国国立卫生研究院(NIH)的同事首次从多种小鼠肿瘤模型中分离出肿瘤浸润淋巴细胞TIL。证明在MC38结肠腺癌模型中,TIL联合IL-2治愈100%小鼠肝转移和50%肺转移。
1984年,Mark Davis 和 Tak Wah Mak教授鉴定出TCR的基因序列和在基因组中的位置,从此掀开了1980-1990年代的TCR狂潮。
1988年,TIL开启在临床上治疗的最早尝试:TIL疗法转移性黑色素瘤达到60%的客观缓解率(ORR)。
1993年,第一代CAR问世(CD3ζ)。
1996年,哈佛大学Don Wiley教授第一次展示出高分辨率的TCR-MHC结合结构图,像一个酒杯,又由于鉴定TCR-MHC这个过程之难和复杂,于免疫学之重要性,TCR被喻为“免疫学圣杯”,Peter Doherty和Rolf Zinkernagel教授也荣获诺贝尔奖。
2003年,第二代CAR问世(CD28-CD3ζ);首次证实CD19可以作为有效靶点。
2004年,第三代CAR问世(4-1BB-CD3ζ)。
2011年,第四代CAR问世(TRUCKs)。
2011年,TIL领域领头羊Iovance公司在2011年从Rosenberg教授获得TIL的专利许可,并获得了化合物、生产、技术更新等众多专利。至此,TIL的商业化开发之路正式开始。
2012年,全球首位被CAR-T细胞免疫疗法治愈的白血病儿童——Emily Whitehead,已实现无癌生存10年。宾夕法尼亚州科学家、T 细胞治疗领域的先驱Carl June 教授使用第二代CD19 CAR-T 细胞成功治愈了患有急性淋巴性白血病女孩Emily Whitehead。
2012年,肝内胆管癌晚期患者Melinda Bachini成为接受TILs疗法后首位实现完全缓解(CR)的患者,至今已幸存10年。
2016年5月,魏则西事件持续发酵,原卫计委全面叫停细胞免疫治疗临床应用。
2017“细胞治疗元年”。
2017年8月,FDA批准全球首款细胞治疗产品Kymriah,治疗急性淋巴细胞白血病,2018年新增适应症大B细胞淋巴瘤,2022年新增适应症滤泡性淋巴瘤。
2017年10月,FDA批准第二款Yescarta,治疗大B细胞淋巴瘤(首款治疗非霍奇金淋巴瘤),2021年新增适应症滤泡性淋巴瘤。
2019年,诺华宣布放弃CAR-T实体瘤的开发。
2019年,Lovance是TILs疗法标杆企业,第一次在临床研究中向监管机构和肿瘤研究者们展现TIL治疗实体瘤的潜力。FDA授予LN-145突破性疗法认定,治疗在接受化疗后复发、转移性或持久性宫颈癌患者。随着FDA批准,TIL疗法日渐展现出蓬勃发展态势,2018-2019年,TIL疗法试验数量达到近十年峰值。
2019年2月,FDA批准全球首款iPSC来源的通用型NK疗法FT516的IND申请。
2020年7月,FDA批准第三款产品Tecartus,治疗套细胞淋巴瘤。
2021年,第五代CAR问世,同时激活TCR,共激域CD28,细胞因子三重信号,是T细胞结合抗原时被激活的前提条件。证实了在血液瘤和实体瘤模型中,较第二代,第五代CAR通过基因改造增强T细胞增值、存活及抗肿瘤效果。
2021年2月,FDA批准第四款Breyanzi,治疗大B细胞淋巴瘤。
2021年3月,FDA批准第五款Abecma,全球首款治疗多发性骨髓瘤。
2021“中国细胞治疗元年” 。
2021年6月,NMPA批准首款奕凯达,治疗大B细胞淋巴瘤。
2021年9月,NMPA批准第二款倍诺达,治疗大B细胞淋巴瘤。
2022年1月,FDA批准首款TCR-T产品Kimmtrak,首款治疗不可切除性或转移性葡萄膜黑色素瘤(mUM)。
2022年2月,FDA批准第六款且首款中国原研产品,传奇生物的Carvykti,治疗多发性骨髓瘤。
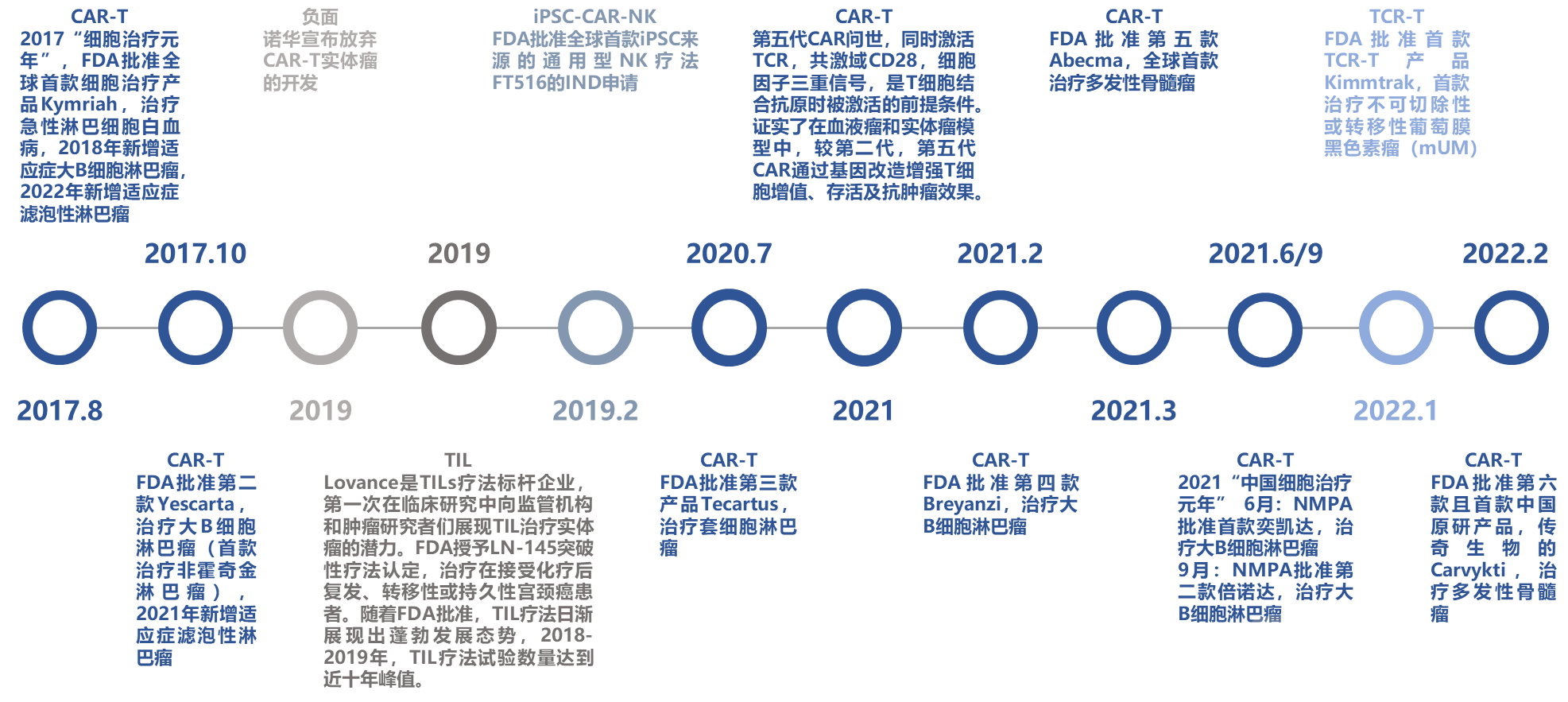
资料来源:公开信息,蛋壳研究院
1.4 全球免疫细胞治疗研发热度不减,中国位居全球第二
全球免疫细胞治疗研发热度不减
总量视角:据Nature报道,截至2022年4月15日,全球免疫细胞治疗药物共计2756种,较2021年2031种活性药物,仍维持36%的快速增长。
靶点视角:2022年全球免疫细胞治疗靶点共计460个,同比增速31%。
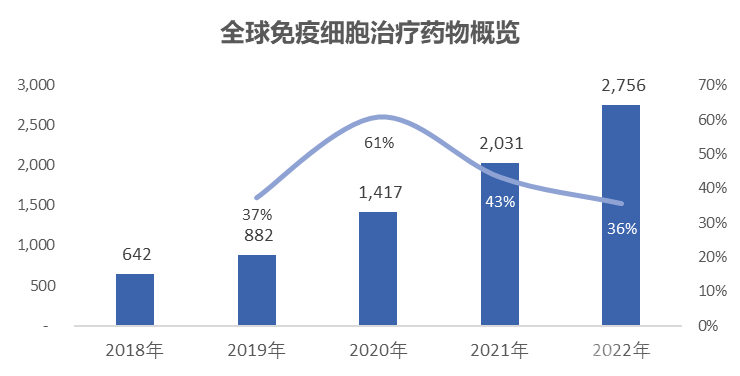
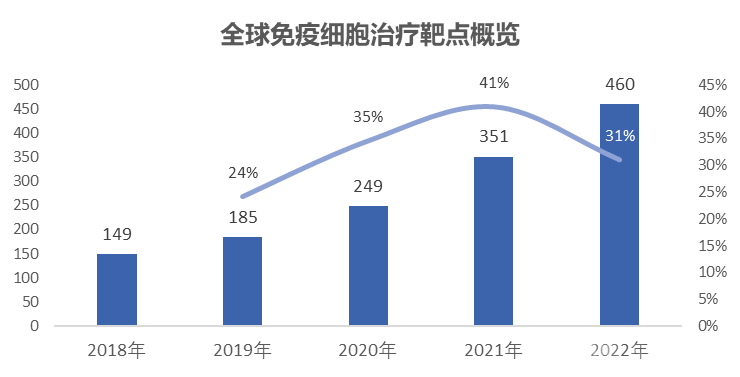
资料来源:Nature,蛋壳研究院
中国位居全球第二,紧随美国
区域视角:中国研发数量位居全球第二,紧随美国。2021年,中国管线合计695项,增速47%超过美国(美国合计791项,增速40%)。进一步从研发属性视角,2021年中国的商业研究数量增速高达74%,占比从51%快速增至60%(同期美国的商业研究数量增速为48%,占比83%)。
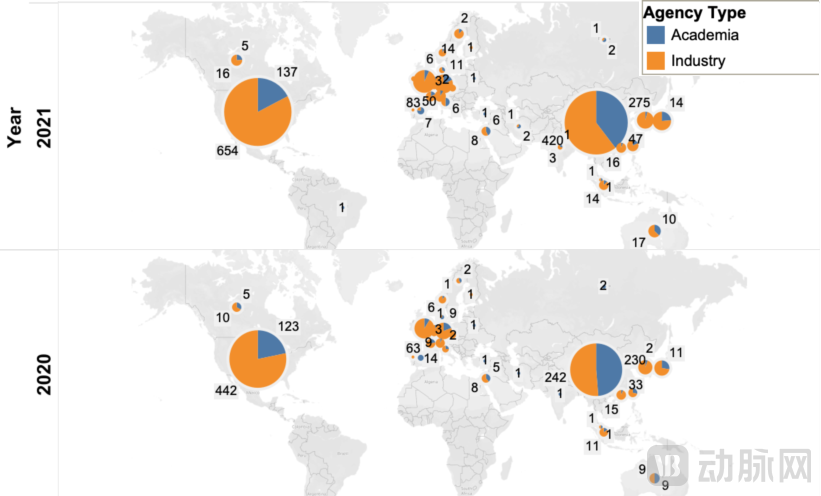

资料来源:Nature,蛋壳研究院
2.1 常见的四类免疫细胞治疗概览
CAR-T——当前最成熟的免疫细胞疗法
■ 疗法概述
CAR-T(Chimeric Antigen Receptor-T cell):嵌合抗原受体T细胞。
通过基因工程,向T细胞导入人造的特异性识别肿瘤抗原的CAR基因,构建CAR-T细胞,再回输患者体内。
CAR-T的关键是CAR受体分子的设计。人工构建的CAR-T不再受MHC限制, T细胞可直接与肿瘤细胞表面的特异性抗原结合而被激活,从而高效杀伤肿瘤细胞。
■ 杀瘤机制
CAR-T通过CAR的肿瘤抗原单链抗体scFv,T细胞直接与肿瘤细胞表面的特异性抗原结合而被激活。
(1)释放穿孔素、颗粒酶素B等细胞毒性颗粒,直接介导肿瘤细胞的溶解;
(2)释放粒细胞巨噬细胞集落刺激因子(GM-CSF),干扰素-γ(IFN-γ)等炎症因子,招募巨噬细胞等人体内源性固有免疫细胞杀伤肿瘤细胞。在这个过程中,还形成免疫记忆T细胞从而获得特异性的抗肿瘤长效机制。
■ 适应症&主要靶点
适应症:主要为血液瘤,包括多发性骨髓瘤、急性淋巴细胞白血病 、非霍奇金淋巴瘤(大 B 细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤)、霍奇金淋巴瘤、急性髓系白血病等。
主要靶点:肿瘤细胞表面蛋白,例如CD19、BCMA等。
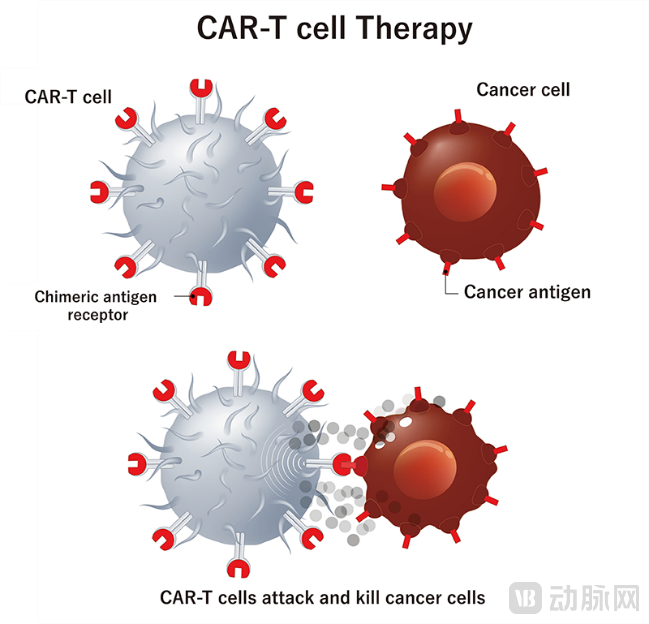
资料来源:cell and gene,蛋壳研究院
TCR-T——第一代免疫细胞疗法,衍生出CAR-T
■ 疗法概述
TCR-T(T Cell Receptor-T cell):T细胞受体嵌合T细胞。
通过基因工程,向T细胞导入天然的特异性结合肿瘤抗原的TCR基因,构建TCR-T细胞,再回输患者体内。
TCR-T是最原始的细胞疗法,MHC限制性,由此改造出第一代CAR-T。因为TCR的可变区只能结合与MHC形成复合体的抗原,而抗体的可变区可直接与抗原结合。因此,科学家将TCR的可变区替换为抗体的可变区,由此构建出非MHC限制性而直接识别特定抗原的第一代CAR-T。
■ 杀瘤机制
TCR-T基于TCR识别更大范围的潜在肿瘤特异性抗原,尤其对低水平/变异的胞内抗原超敏感识别。
(1)抗原呈递细胞APC吞噬肿瘤抗原被并降解为多肽,再与组织相容性复合物(MHC)结合呈递在APC膜表面;
(2)当一类T细胞的TCR与APC膜表面的组织相容性复合物-多肽综合体(MHC-Peptide Complex)结合,T细胞在共刺激受体/配体(如B7-CD28)作用下被激活,从而特异性杀伤肿瘤细胞。
■ 适应症&主要靶点
适应症:主要为实体瘤(占86%),包括黑色素瘤、滑膜肉瘤、软组织肉瘤、肝癌、非小细胞肺癌、卵巢癌、头颈鳞癌、上皮癌等;血液瘤,包括多发性骨髓瘤、淋巴细胞白血病等。
主要靶点:肿瘤细胞表面及内部抗原经APC细胞呈递后的MHC-抗原复合体,例如NY-ESO-1 、MAGE-A4、GPC3、AFP等。
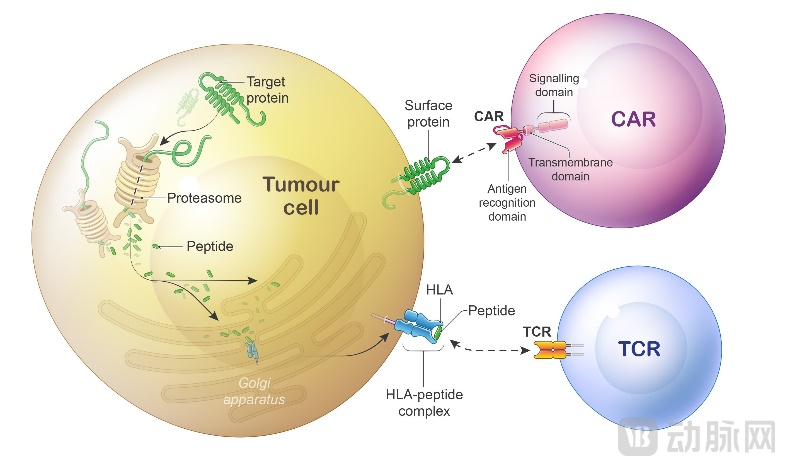
资料来源:zelluna,蛋壳研究院
CAR-NK——细胞来源广,商业化前景广阔
■ 疗法概述
CAR-NK(Chimeric Antigen Receptor-Natural Killer):嵌合抗原受体自然杀伤细胞。
通过基因工程,向NK细胞导入人造的CAR基因,再回输患者体内。
不同于T细胞,NK属于固有免疫细胞,无需提前由抗原致敏,是机体抗肿瘤的第一道防线,MHC非限制性。 “天然杀手” 快速识别并杀伤突变的肿瘤细胞。NK主要来源于骨髓CD34+淋巴细胞,占外周血淋巴细胞10-20%。NK杀伤机理不同于T细胞,NK活性受其细胞表面一系列KIR和KAR的平衡所调控,并不依赖于肿瘤细胞上的某个特定抗原。
■ 杀瘤机制
(1)释放细胞质颗粒直接杀伤:穿孔素、颗粒酶等细胞毒性颗粒;
(2)细胞因子介导的杀伤作用:释放IFN-γ, TNF-α, GCSF等,与肿瘤细胞表面的受体作用,诱导其凋亡;
(3)激活ADCC作用:NK细胞的Fc受体CD16与肿瘤抗原特异性抗体的Fc段结合,激发抗体依赖性细胞介导的细胞毒性作用ADCC,杀伤肿瘤细胞;
(4)表达肿瘤坏死因子诱导细胞凋亡:凋亡相关因子配体(FasL), 肿瘤坏死因子相关诱导配体(TRAIL)结合等。
■ 适应症&主要靶点
适应症:血液瘤&实体瘤,例如急性髓系白血病、多发性骨髓瘤、淋巴细胞白血病、胃癌、非小细胞肺癌、卵巢癌、乳腺癌、胰腺癌等。
主要靶点:肿瘤细胞表面蛋白,例如CD19、CD20、HER2等。
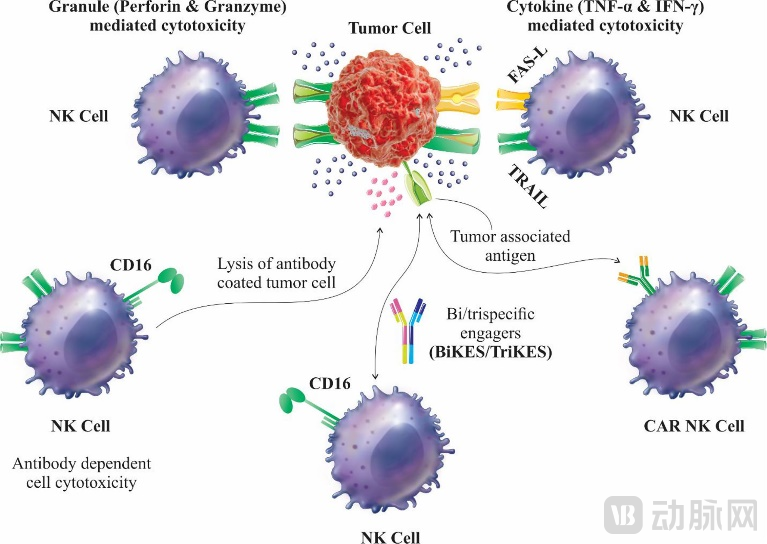
资料来源:frontiers,蛋壳研究院
TIL——广谱抗实体瘤优势不可比拟
■ 疗法概述
TIL(Tumor Infiltrating Lymphocytes): 肿瘤浸润淋巴细胞。
TIL天然存在,是从患者肿瘤组织中分离出的一类特殊的T细胞,体外扩增后再回输患者体内。
TIL具备肿瘤特异性抗原识别的能力(肿瘤识别率超60%),深入肿瘤组织内部并杀伤肿瘤细胞,是机体抗肿瘤的特异性免疫反应。不同于基因改造的细胞疗法,TIL不是单个T/NK细胞的克隆,而是包含多种肿瘤特异性抗原的T细胞,TIL通常由效应记忆T(Tem)细胞组成。
■ 杀瘤机制
T细胞在TCR和CD28的双刺激信号下,转变为效应T细胞,直接杀伤或分泌干扰素等因子杀伤肿瘤细胞。
(1)释放细胞质颗粒:穿孔素、颗粒酶等,穿孔素使肿瘤细胞表面形成多聚孔道,通过渗透压改变或与颗粒酶协同,引发肿瘤细胞溶解或凋亡。
(2)表达肿瘤坏死因子诱导细胞凋亡:T细胞表面的Fas与肿瘤细胞表面的FasL结合。
■ 适应症&主要靶点
适应症:广泛的实体瘤(20+种),包括黑色素瘤(超50%),非小细胞肺癌、卵巢癌、头颈癌居多,宫颈癌、乳腺癌、结直肠癌、肝癌、胰腺癌、胆管癌、输卵管癌、鼻咽癌、胸膜间皮瘤等。
主要靶点:对靶点无要求,可同时激发多个靶点的抗肿瘤效应。
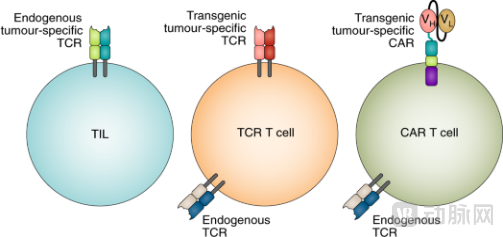
资料来源:nature nanotechnology,公开信息,蛋壳研究院
2.2 CAR-T占据“半壁江山”,NK持续高增,TCR-T和TIL疗法增速放缓
技术路径视角:CAR-T占据“半壁江山”,NK持续高增。截至2022年4月15日,全球免疫细胞治疗药物2756种(+36%),其中CAR-T细胞疗法1432种占比52%,增速25%较上年同期38%有所放缓;NK细胞疗法283种,仍维持55%的高位增速(上年同期+65%)。另外,不同于T细胞的其他疗法(APC/DC细胞等)在2022年爆发式增长129%(上年同期+37%)。TCR-T和TIL增速放缓。TCR-T细胞疗法269种,增速23%较上年同期65%大幅放缓;TIL细胞疗法91种,增速32%也较上年同期68%大幅放缓。
研发进度视角:大部分管线尚在临床前。CAR-T/TCR-T/NK/TIL各路径的临床前占比分别为60%/75%/74%/59%,CAR-T/TCR-T/NK的临床1/2期占比大致在10-20%,TIL临床2期占36%。
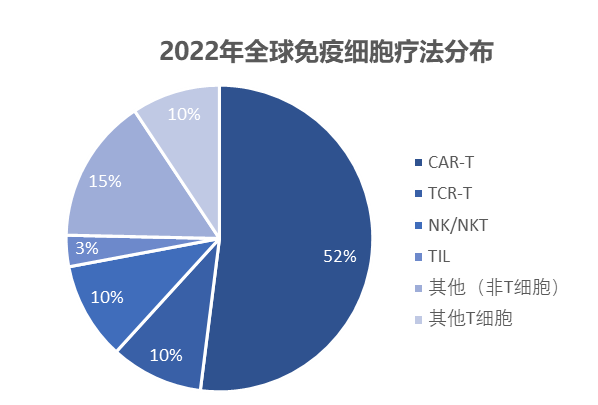
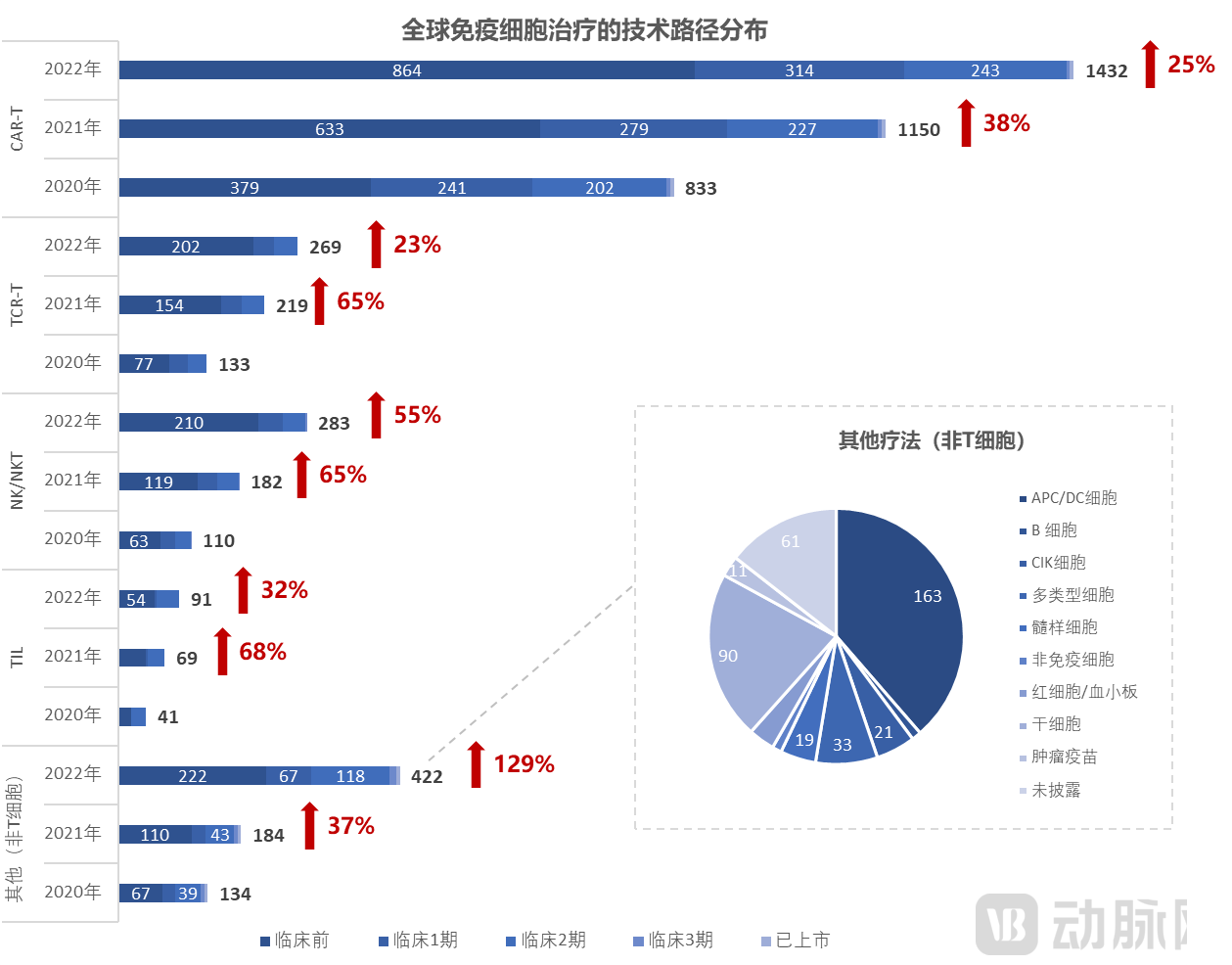
资料来源:Nature,蛋壳研究院
2.3 CAR-T获批产品自体制备、定价高昂阻碍患者可及性,适应症扎堆于血液瘤
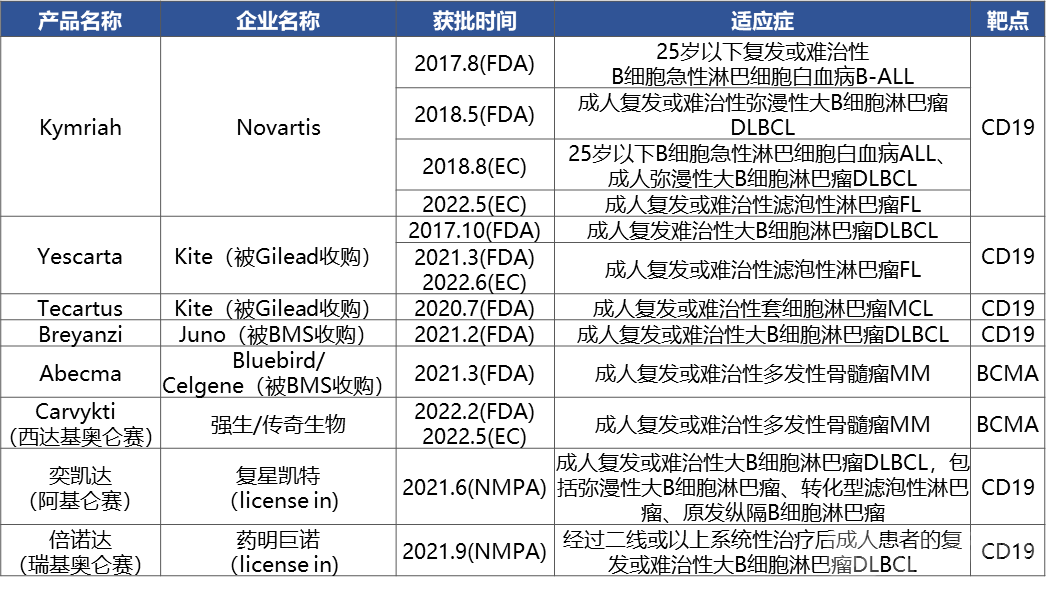
全球获批CAR-T的适应症均为血液瘤,患者自体制备导致终端定价高昂。
FDA批准6款产品上市,NMPA批准2款产品license in。2017年8月,FDA批准全球首款产品Novartis的Kymriah,并先后获得3类适应症获批。值得一提的是,传奇生物自主研发的Carvykti(西达基奥仑赛)分别于2022年2月获得FDA、2022年5月获得EC批准,用于治疗成人复发或难治性多发性骨髓瘤。
已获批适应症集中于血液瘤,靶点扎堆于CD19/BCMA:包括成人复发难治性弥漫性大B细胞淋巴瘤DLBCL、复发或难治性B细胞急性淋巴细胞白血病B-ALL、成人复发或难治性多发性骨髓瘤MM、成人复发或难治性滤泡性淋巴瘤FL、成人复发或难治性套细胞淋巴瘤MCL等。
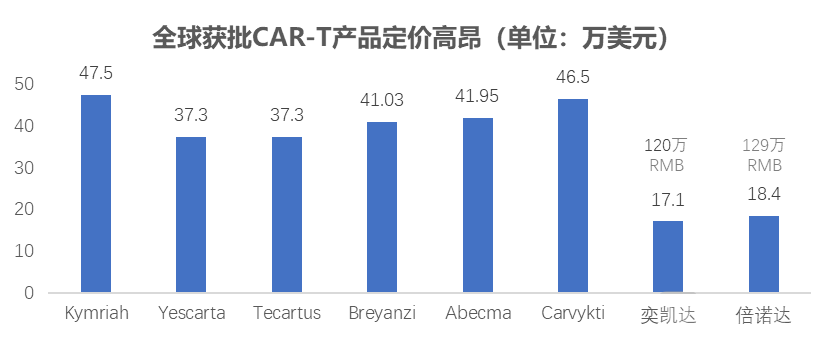
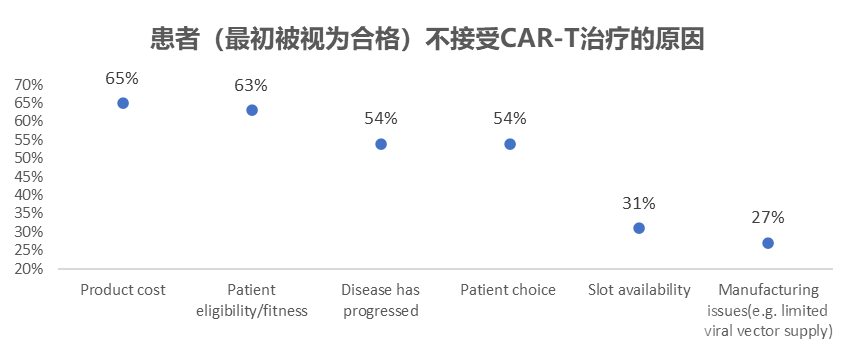
已获批产品均为自体制备CAR-T,终端定价高昂阻碍患者可及性:Nature真实世界研究,对最初被判定合格的患者,但最终未接受治疗的原因进行了调查。结果:费用是患者接受细胞治疗的主要障碍(65%),其次是患者种类是否适合(63%),及疾病进展(54%)。患者等待时间、病毒载体供应不足等也是重要原因。
资料来源:公开信息,Nature,蛋壳研究院
2.4 突围思路1——现货通用型产品更具商业化前景
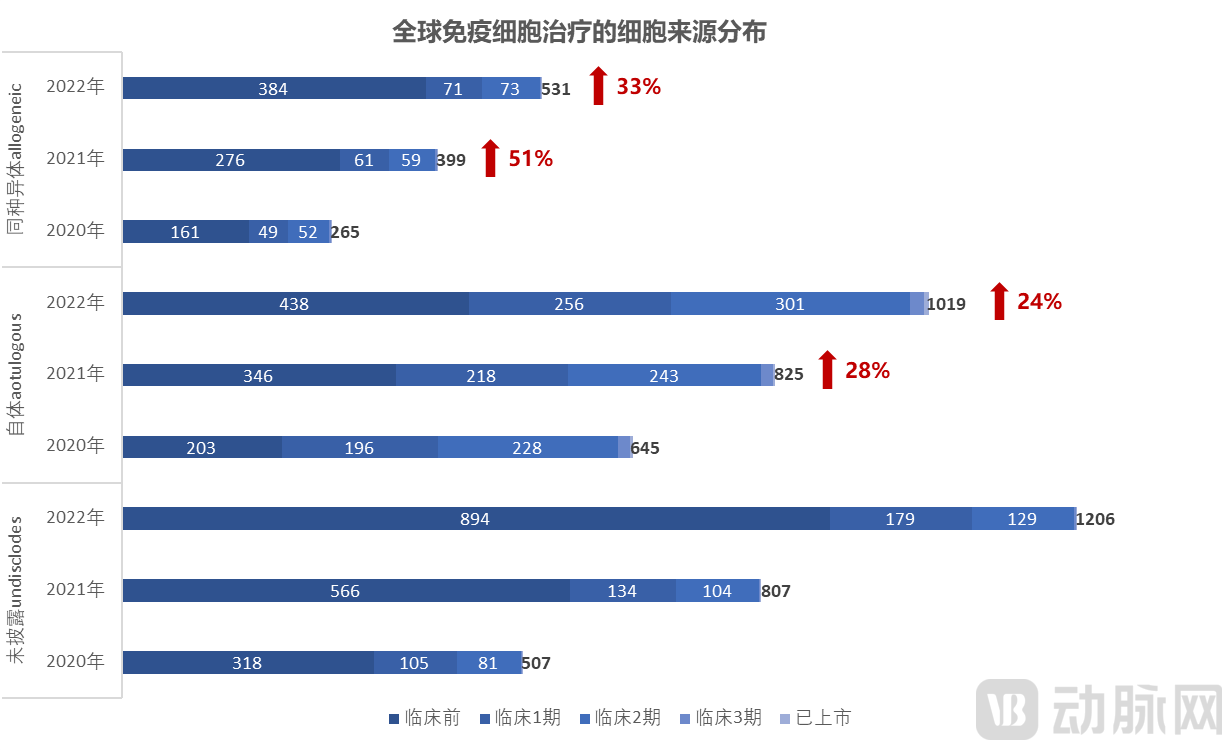
细胞来源视角:自体来源仍是主流,通用型来源加速追赶。截至2022年4月15日,全球免疫细胞治疗药物2756种,披露细胞来源的药物中,自体来源1019种(+24%),通用型来源仅531种(+33%)。自体/通用型比例,从2020年的接近2.5倍,降低至2022年的不到2倍。但从商业化前景角度考虑,自体细胞治疗更像“服务”,制备成本和患者可及性永远是痛点;通用型细胞治疗才更像“药物”,具备规模化应用前景,因此当前管线分布的合理性有待提升。
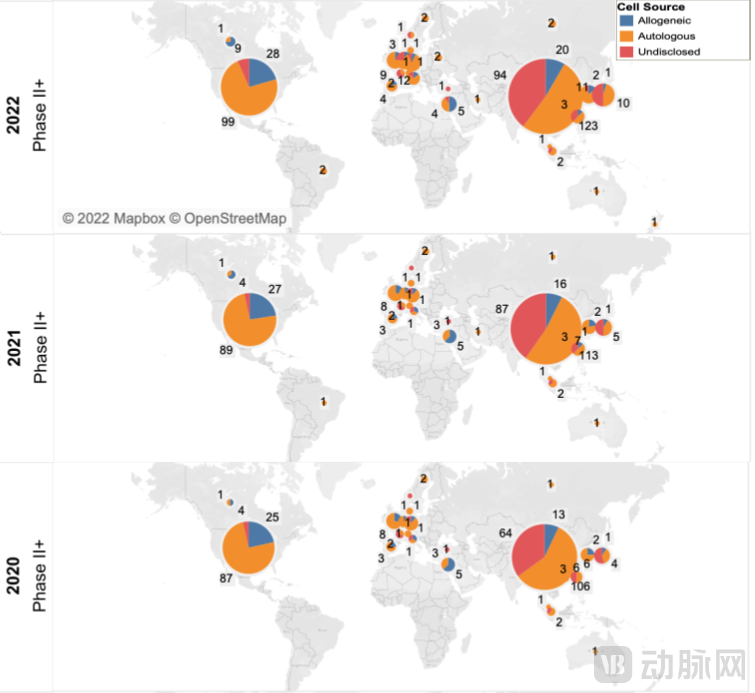
资料来源:Nature,蛋壳研究院
2.5 突围思路2——攻克占90%市场的实体瘤,寻找差异化靶点
适应症视角:超50%落在血液瘤,近两年实体瘤管线数量高速增长。2022年实体瘤/血液瘤管线数量分别增长44%/25%,虽然实体瘤管线近两年维持40%以上的增速,占比43%,但从占据90%市场需求角度,实体瘤仍是重要攻克方向。
靶点视角:依旧扎堆。血液瘤:CD19、BCMA和CD22靶点仍居榜首。一些新靶点高速增长,包括GPRC5D(+200%),CLEC12A(+114%)和CD7(+78%) 。实体瘤:TAAs、HER2和MSLN仍是最常见的靶点,其中TAAs增速220%。另外高速增长的靶点包括CLDN18(+400%)、CD276(+160%)、KRAS(+125%)、CD22(+100%)等。
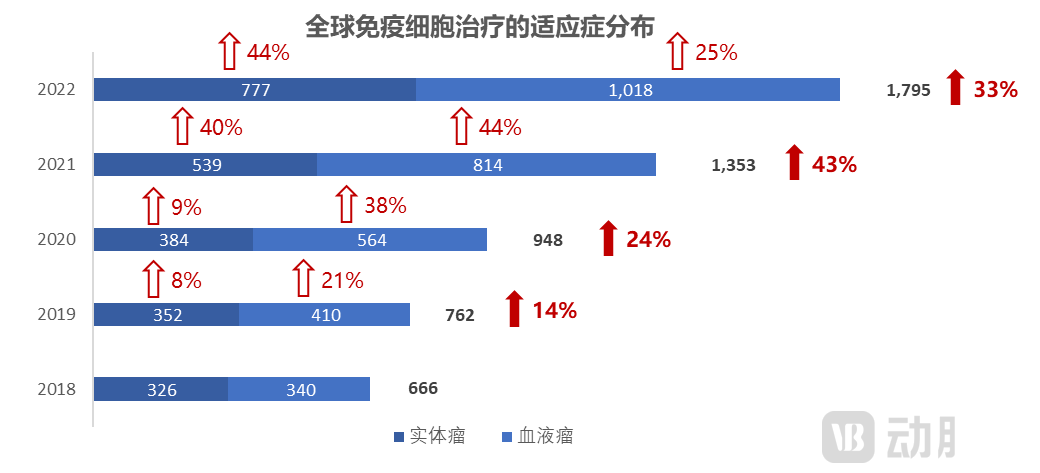
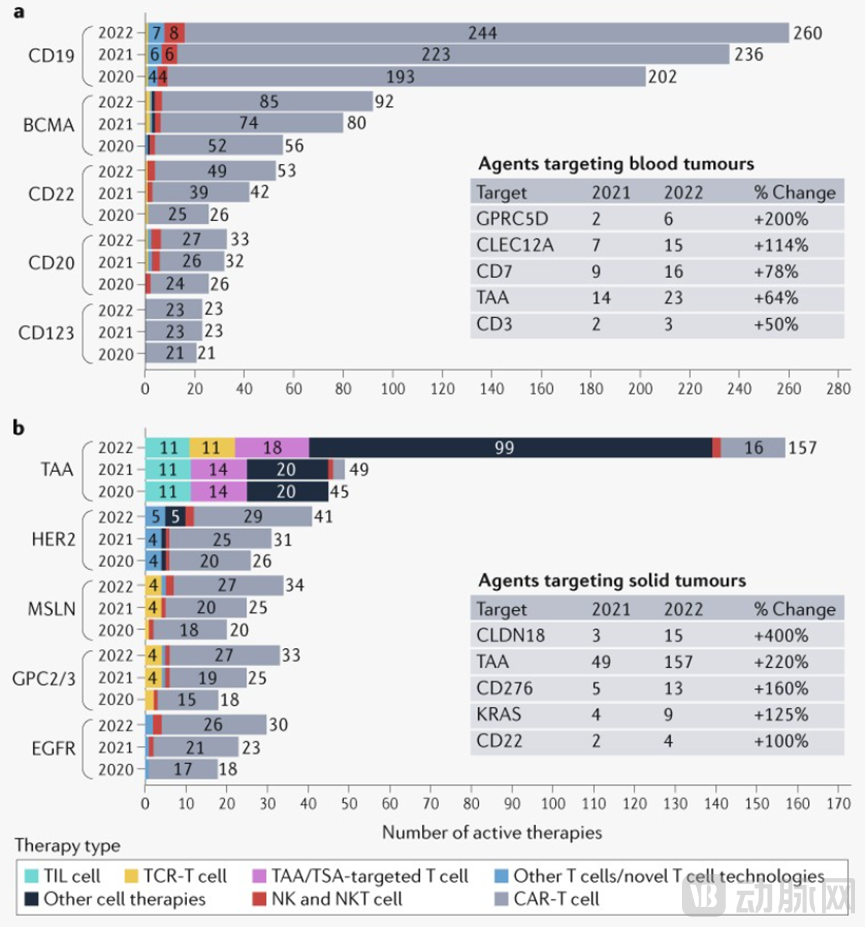
资料来源:Nature,蛋壳研究院
3.1 CAR-NK兼具安全性+有效性优势,iPSC来源的NK商业化前景广阔
血液瘤领域:自体CAR-T的疗效已被验证,FDA批准6款产品。
实体瘤领域:TIL本身来源于患者肿瘤组织,理论上可应对所有癌种,在广谱抗癌角度具备不可比拟的优势;另外,TCR-T优势在于高敏感识别胞内抗原(占90%)且对实体瘤内部渗透性强;CAR-NK的多机制协同杀瘤优势显著,不仅通过CAR依赖途径识别肿瘤抗原阳性的癌细胞,同时NK细胞作为自然杀伤细胞本身具备固有免疫能力,尤其通过激发抗体依赖性细胞介导的细胞毒性作用(ADCC)达到杀瘤目的。
商业化视角:CAR-NK最具优势,因为NK细胞获取来源广,且均质稳定,适宜大规模商业化生产;另外,UCAR-T也具备即用优势,但成本降幅不及NK。
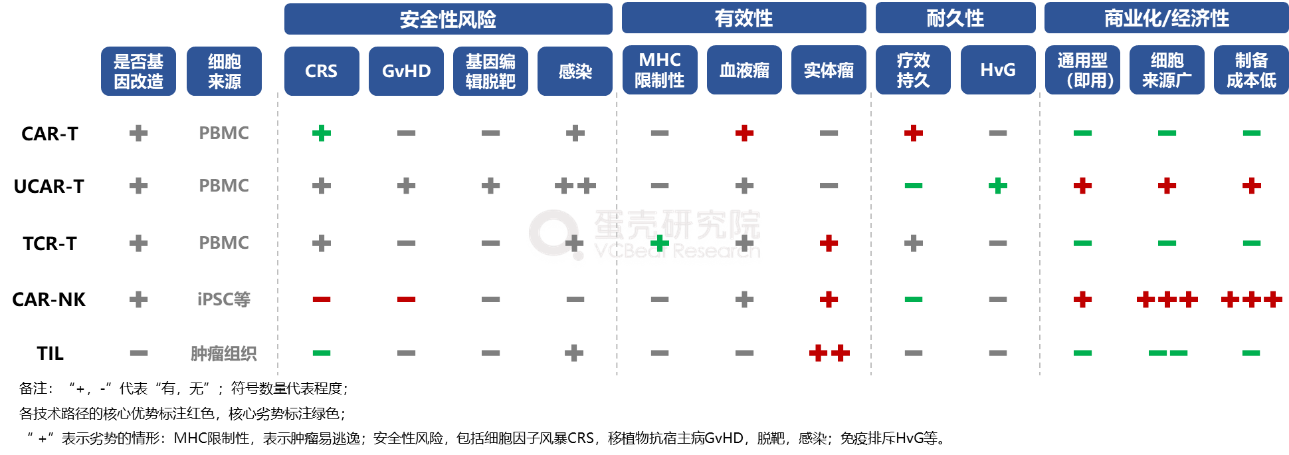
资料来源:公开信息,蛋壳研究院梳理
3.2 不同技术路径各显神通,CAR-NK或成终路径
CAR-T——血液瘤疗效佳;但商业化前景渺茫
■ 优势
【有效性】血液瘤杀伤效果好:根据目标靶点,人工设计优化CAR受体结构,因此CAR-T细胞一旦结合靶点分子即被激活,不受MHC限制性、共刺激分子影响,发挥杀瘤作用。
【耐久性】疗效持久: CAR-T细胞进入患者体内后增殖活化,长期在体内存活,治疗效果持久。患者输注一次CAR-T细胞,治疗效果可维持数年,无需反复注射抗体类药物或化疗。
■ 劣势
【安全性】细胞因子风暴CRS,神经毒性:导致脑水肿等严重不良事件。
【商业化】自体型,制备非标化,成本高,周期长,患者可及性差:上市产品40-50万美元,制备3周左右,但晚期患者“等不起”或难以获取合格质量/数量T细胞,导致生产失败。
【有效性】实体瘤疗效不理想:CAR-T细胞由于亲和力过高,在患者体内易被阻滞在实体瘤外,不易进入肿瘤内部。
UCAR-T——成本大幅降低;但疗效打折
■ 优势
【商业化】通用型,制备标准化,成本低,即用型,患者可及广:来源于健康供者的T细胞质量好,只需一次制备可得百余份患者所需剂量;成本大幅降低至自体的1/10;GMP标准化流程可质控所有指标,产品稳定;患者无需等待可立即输注接受治疗,尤其针对T细胞无法扩增的极晚期患者意义重大。
■ 劣势
【耐久性】疗效不持久,免疫排斥HvG:影响CAR-T扩增,多家头部管线难过6个月大关。
【安全性】(1)细胞因子风暴CRS。(2)移植物抗宿主病GvHD:造成机体器官损伤风险。(3)基因编辑脱靶:敲除异体CAR-T的TCR/HLA等。(4)多次清淋增加感染风险:较自体CAR-T更依赖清淋化疗。
TCR-T——胞内抗原识别广;但无法通用型
■ 优势
【有效性】(1)实体瘤抗原识别广: 识别数量占90%的胞内抗原(CAR-T仅识别表面抗原)。(2)灵敏度高:尤其可高敏感识别更大范围的低水平/变异的胞内抗原(CAR-T对抗原的灵敏度低很多,需300-400个表面抗原)。(3)渗透性强:且对实体瘤组织内部的渗透性强(TCR-T亲和力弱,深入肿瘤内部,86%应用于实体瘤;而CAR-T由于亲和力过强易被阻滞在实体瘤外部)。
【耐久性】疗效持久:TCR来源天然,不易产生免疫排斥HvG。因为TCR-T引入的是完全来自于人体天然筛选出的TCR结构序列,相比于CAR-T引入的是人为改造的CAR基因,机体对TCR的排斥更弱。
■ 劣势
【商业化】自体型,制备成本高:由于TCR-T是MHC依赖性( TCR-T对肿瘤细胞的靶向杀伤需要MHC分子),人群中HLA的特异性过于多样化,因此 TCR-T疗法无法类似CAR-T研发出通用型TCR-T ,而只能针对某些HLA表型的人去使用。
【有效性】MHC限制性,肿瘤易逃逸:因为TCR-T的活化依赖MHC-I类分子将肿瘤抗原呈递给TCR-T,且需要共刺激信号等,因此TCR-T的细胞活化过程较CAR-T困难,同时肿瘤细胞可通过下调MHC-I类分子而逃逸TCR-T细胞免疫疗法的杀伤,导致疗效不理想。
CAR-NK——安全性最佳,成本极低;重复输注克服耐久性
■ 优势
【安全性】(1)暂未报道细胞因子风暴CRS或神经毒性,异体无移植物抗宿主病GvHD :CAR-NK 不分泌IL-1、IL-6等炎症型细胞因子。同时,NK细胞体内存活时间短且无法穿透血脑屏障,较CAR-T不易出现活化细胞在体内存活太久而杀伤正常组织,因此不易产生长期毒副作用。因为UCAR-T的GvHD是由于T细胞的HLA等导致,NK细胞无此机制。(2)NK细胞天然具备抗感染能力:CAR-NK细胞对细菌、真菌、其他病毒等病原体也有防御作用,有助于防治并发和继发感染。
【有效性】(1)多机制协同杀实体瘤优势显著:不仅通过CAR依赖途径识别肿瘤抗原阳性的癌细胞;同时NK细胞本身具备固有免疫能力,可识别表达NK细胞受体配体的癌细胞,释放细胞质颗粒、细胞因子激活肿瘤细胞表面凋亡受体的表达。重点强调:激发抗体依赖性细胞介导的细胞毒性作用(ADCC),和抗体药联用,可增强抗体药通过ADCC诱导NK细胞杀瘤的机制。(2)MHC非限制性杀瘤:NK细胞本身表达的免疫检查点分子(PD-1等)较CAR-T弱,所以免疫微环境的抑制弱。即使肿瘤细胞下调CAR的靶向抗原,NK细胞依然能够杀伤肿瘤细胞,实体瘤更有优势。
【商业化】通用型,细胞来源广泛,制备成本极低: NK细胞获取来源广泛且数量庞大(尤其iPSC来源,预估成本若降低至抗体药水平,相比于UCAR-T,存在2个数量级的优势),在体外的分离和扩增相对简单,质量均一且时效高,适宜大规模商业化生产,无需患者自身提取,及时获得治疗。
■ 劣势
【耐久性】体内存活时间短:在缺乏IL-2和IL-15时,CAR-NK细胞在体内存活时间不长,且NK细胞本身对冻融过程敏感,过早死亡的NK细胞导致治疗效果有限。但重复输注可克服耐久性不佳的弊端,同时成本足够低至患者可承受多次输注治疗。
TIL——广谱抗实体瘤;但采样制备繁琐
■ 优势
【安全性】来源于患者自身肿瘤组织,基本无毒副作用:TIL是人体固有的T细胞,经体内选择,TIL仅特异性识别肿瘤抗原,不识别正常组织,同时无免疫原性(不会被免疫系统识别为外来抗原),毒副作用小(唯一来源是高剂量的IL-2毒性),且几乎无脱靶毒性(TIL靶向性来源于自身机体训练而得,非人工改造),也不存在CRS。
【有效性】(1)广谱抗实体瘤的优势不可比拟:TIL本身来源于患者肿瘤组织,特异性识别多种肿瘤抗原,理论上可应对所有癌种。 已在全球开展转移性黑色素瘤、鼻咽癌、头颈部鳞状细胞癌、胆管癌、复发/难治卵巢癌、骨肉瘤、宫颈癌、卵巢癌、非小细胞肺癌、脑胶质瘤、胸膜间皮瘤等多种实体瘤临床试验,较TCR-T,CAR-NK更为广泛。(2)天然的肿瘤识别和浸润能力:TIL分离于已浸润肿瘤的细胞,已经历完整的致敏及淋巴结激活,具有较高表达的归巢受体及较好的细胞运动能力,回输后更高效地被肿瘤相关趋化因子吸引而浸润肿瘤。不同于CAR-T/TCR-T来源于血液,TIL对肿瘤识别率超60%。(3)天然多靶点,无需人工发现:克服肿瘤异质性问题。肿瘤由多种不同基因突变型的癌细胞组成。CAR-T等只识别某种突变型的癌细胞,即便完全清除该类癌细胞,也难以阻止其他突变型的癌细胞生长。TIL由于天然浸润在肿瘤组织内部,接触过多种肿瘤特异性抗原,TIL不是单个T细胞克隆,而是包含多种肿瘤特异性抗原的T细胞。
■ 劣势
【商业化】(1)自体型,高度定制化,成本高,周期长:体外扩增成功率低。(2)细胞来源难:新鲜肿瘤样本难获得且对患者不友好(需手术),具抗肿瘤活性、增殖能力强的TIL难获得(取决于肿瘤组织周围是否有足够的T细胞浸润)。
【耐久性】体内存活时间短:TIL多为耗竭性T细胞,且体外长时间筛选扩增培养更易耗竭。 同时,TIL也面临肿瘤组织内的免疫微环境抑制:PD-1配体PD-L1/L2可以在多种肿瘤类型中表达,能够与受体相互作用形成抑制性微环境,从而抑制效应T细胞功能和加快T细胞衰竭。
以上为报告主要内容节选,报告完整框架如下,扫描二维码,主动询问即可免费下载报告全文。

第一篇 免疫细胞治疗“活药物”疗效凸显,全球研发热度不减
1.1 免疫细胞治疗——肿瘤免疫疗法中的“活药物”,疗效优势凸显
1.2 第一代CAR克服TCR的MHC限制性,各代CAR旨在加强细胞的增殖及杀伤力
1.3 发展历程:CAR-T后来居上,血液瘤疗效显著,屡获FDA批准(2/2)
1.4 全球免疫细胞治疗研发热度不减,中国位居全球第二
第二篇 免疫细胞治疗的研发现状及突围思路
2.1 常见的四类免疫细胞治疗概览
2.2 CAR-T占据“半壁江山”,NK持续高增,TCR-T和TIL疗法增速放缓
2.3 CAR-T获批产品自体制备、定价高昂阻碍患者可及性,适应症扎堆于血液瘤
2.4 突围思路1——现货通用型产品更具商业化前景
2.5 突围思路2——攻克占90%市场的实体瘤,寻找差异化靶点
第三篇 浅谈技术路径视角的发展前景
3.1 CAR-NK兼具安全性+有效性优势,iPSC来源的NK商业化前景广阔
3.2 不同技术路径各显神通,CAR-NK或成终路径
CAR-T——血液瘤疗效佳;但商业化前景渺茫
UCAR-T——成本大幅降低;但疗效打折
TCR-T——胞内抗原识别广;但无法通用型
CAR-NK——安全性最佳,成本极低;重复输注克服耐久性
TIL——广谱抗实体瘤;但采样制备繁琐




























