美东时间10月13日周五美股收盘后,辉瑞发布《辉瑞修订美国政府Paxlovid供应协议并更新2023年业绩指引》的公告,表示受新冠产品影响,公司决定再次下调业绩预期。
当前预计今年全年的营业收入范围在580亿到610亿美元,较之前给出的指引范围670亿到700亿美元大幅下调90亿美元,降幅约12.9%到13.4%。其中,公司将 Paxlovid的2023年全年收入预期下调了约70亿美元,将Comirnaty 2023年全年收入预期下调了约20亿美元。
 图片来源:辉瑞官网截图
图片来源:辉瑞官网截图
因Paxlovid(奈玛特韦片/利托那韦片)已从政府的紧急供应转为商业市场供应,政府预计将退还已在全国各地分发的药品,总计约790万个疗程。由于这些退货和退款,Paxlovid今年的销售额将比公司之前预测的低70亿美元。
受此次COVID产品预期收入下降和库存注销的影响,公司也将每股收益指导值同步下调至1.45-1.65美元。为此,公司随即启动了成本调整计划,该部分成本主要包括遣散费和实施成本,根据对长期收入预期的调整,整体计划节约35亿美元。其中约10亿美元预计在2023年完成,以抵消部分2023年收益影响,2024年还将至少实现约25亿美元。
除降低预期收入和实施成本调整规划外,辉瑞也通过修订与政府的供应协议,调整了Paxlovid在2024年的美国商业化提供途径,以消除众多不确定性。
美国政府在年底退还贴有EUA标签的Paxlovid产品后,将从辉瑞获得贴有NDA标签产品的抵免额度。同时,辉瑞将继续通过一项患者援助计划为联邦医保患者免费提供Paxlovid至2024年,同时为无医保/医保不足的患者免费提供Paxlovid至2028年,并在产品交付时获得一定收入。另外将有100万个疗程的Paxlovid作为国家战略储备药物,由辉瑞提供给美国政府。
对此,辉瑞公司董事长兼首席执行官Albert Bourla博士也表示,与新冠疫情相关的收入还将在未来一段时间内为公司的业务做出贡献。
本次战略调整,一方面将提高患者对Paxlovid产品的可获得性,同时也在当前的商业过渡阶段,帮助企业对市场有了更清晰的认知,及时消除了针对后期相关业务预期的不确定性。随着对COVID疫苗接种率和治疗需求的进一步了解,辉瑞将持续评估适应当下的供应水平,以满足公共卫生需求。
本次公告同时表示,公司的非COVID产品组合依旧发展强劲。2023年对该类产品依旧保有信心,预计营业收入将同比增长6%-8%。
针对成年人的RSV疫苗Abrysvo在今年5月拿到FDA上市许可后,7月又再次获得CHMP针对孕产妇免疫接种的积极意见。
Braftovi与Mektovi联合治疗BRAF V600E突变转移性非小细胞肺癌(NSCLC)的第二阶段PHAROS研究结果也表现积极,FDA的相关审查意见将在2023年第四季度公布。
针对治疗青少年(12岁以上)重度斑秃患者的Litfulo产品于今年6月在美国FDA获得批准,CHMP也于7月给出了肯定性意见,并有望在接下来的几个月给出最终结果。
每周使用一次的人类生长激素类似物Ngenla(somatrogon-ghla)也于今年6月获得FDA批准。该产品用于治疗因内源性生长激素分泌不足而导致生长发育迟缓的三岁及以上儿童患者,目前已被 40 多个市场批准用于治疗小儿生长激素缺乏症,包括加拿大、澳大利亚、日本和欧盟成员国。
同月,美国疾病预防控制中心(CDC ACIP)一致投票决定推荐Prevnar 20(20价肺炎球菌结合疫苗)用于所有2岁以下儿童的常规接种,以及2-18岁患有某些潜在疾病的合格儿童的常规接种,并为未完成肺炎球菌疫苗接种的儿童提供补种剂量。
Talzenna(一种口服聚 ADP 核糖聚合酶(PARP)抑制剂)与Xtandi(enzalutamide)联合用于治疗同源重组修复 (HRR) 基因突变的转移性抗性前列腺癌 (mCRPC) 成人患者的疗法,同样在今年6月获得FDA批准。该药物获批的依据是其具有统计学意义和临床意义的放射学无进展生存期 (rPFS) 数据。
除在今年年中获得上市批准的管线外,辉瑞还准备了大量的在研管线。截至2023年8月1日,公司已有90条管线进入临床研究阶段,处于临床I期的管线29条,II期管线28条,III期管线23条,并由10条管线处于注册阶段。从适应症来看,肿瘤学管线32条,内科管线11条,罕见病/非恶性血液学管线9条,疫苗管线15条。
图片来源:辉瑞官网截图
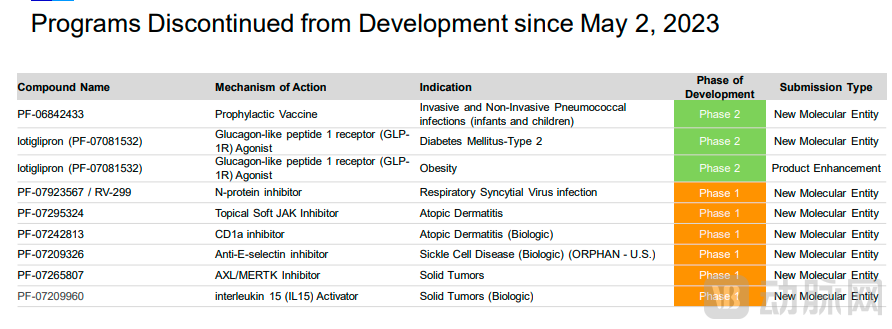
2023年5月2日起停止开发计划的管线共9条。
看得出来,尽管Paxlovid和Comirnaty 的“功绩”在现阶段难以超越,但在当前疫情后的商业过度阶段,辉瑞也在积极挑战、努力寻找新的商业平衡。





























