近日,罗氏公布了2023年度财务报告,表示将从其研发管线中剔除5款神经学领域资产和3款肿瘤资产,其中包括2款治疗阿尔茨海默病(AD)的药物——Crenezumab和Semorinemab,为通过27亿美元收购Carmot Therapeutics(“Carmot”)获得的一系列GLP-1类药物腾出空间。
对此,罗氏首席执行官Thomas Schinecker表示,剔除管线旨在增加整体投资组合价值并加速开发更有价值的资产,在此过程中将在研管线的平衡从神经学和肿瘤学领域转向免疫学、心血管和代谢学领域。
罗氏在2023年取得了不错的成绩。财报数据显示,罗氏2023年收入达587.16亿瑞士法郎(约656.27亿美元),实现1%(CER,以瑞士法郎计算)的销售额增长。
其中肿瘤、神经、免疫、诊断四大驱动平台成为罗氏2023年收入增长的主要引擎。其中,神经类药物Ocrevus(多发性硬化症)销售额达63.81亿瑞士法郎,同比增长13%,成为罗氏2023年最畅销的产品。此外,肿瘤领域在连续多年下滑后首次增长,2023年实现190.87亿瑞士法郎收入,同比增长+4%。神经学疾病领域产品表现同样出色,2023年实现84.45亿瑞士法郎收入,同比增长16%。
在神经学和肿瘤领域产品贡献了公司2023年将近一半的收入后,罗氏选择重塑早期临床试验药物管线,剔除8个处于1期和2期临床试验阶段的神经学和肿瘤领域的候选药物。“瘦身”的目的之一,便是为接下来罗氏进军GLP-1赛道做准备。
2023年12月4日,罗氏宣布进入最终收购Carmot的阶段。根据协议条款,罗氏将向Carmot支付27亿美元的预付款,如果达到某些里程碑,罗氏可能会在未来向Carmot股东追加支付高达4亿美元的额外款项,此次收购预计于今年第一季度完成。
通过此次交易,罗氏将获得Carmot目所有临床和临床前的资产。Carmot是一家致力于代谢性疾病和癌症新药开发的生物技术公司,基于其开创的药物发现技术Chemotype Evolution(CE)来筛选新药,目前专注于GLP-1类新药开发。此次收购,罗氏将获得该公司三项在肥胖症和糖尿病领域具有一流潜力的GLP-1资产,分别是:
CT-388:一种每周皮下注射一次的GLP-1/GIP受体双激动剂,用于治疗2型糖尿病和非2型糖尿病患者的肥胖症,其有可能作为一种独立和联合疗法来改善肥胖,并将扩展到其他适应症。Carmot目前正在进行CT388的多臂、双盲、安慰剂对照1/2期临床试验,以评估该候选药物在超重或肥胖的成年患者中的安全性和耐受性。
CT-868:一种每日一次皮下注射的双重GLP-1/GIP 受体激动剂,用于治疗超重或肥胖的1型糖尿病患者。Carmot目前正在1型糖尿病患者中进行CT-868的1期临床试验,以评估其安全性。此外,Carmot计划对患有1型糖尿病的超重或肥胖患者进行CT868的双盲、安慰剂对照2期概念验证临床试验,评估该药物的有效性、安全性、耐受性和PK。以及一项评估CT-868对胰岛素依赖型2型糖尿病患者血糖控制影响的临床试验。
CT-996:一种每日一次的口服小分子 GLP-1 受体激动剂,用于治疗患有2型糖尿病患者和非2型糖尿病的肥胖患者。Carmot目前正在超重或肥胖以及2型糖尿病患者中开展CT-996的双盲、安慰剂对照1期临床试验,旨在评估该药物C-996 的安全性、耐受性、PK和PD。
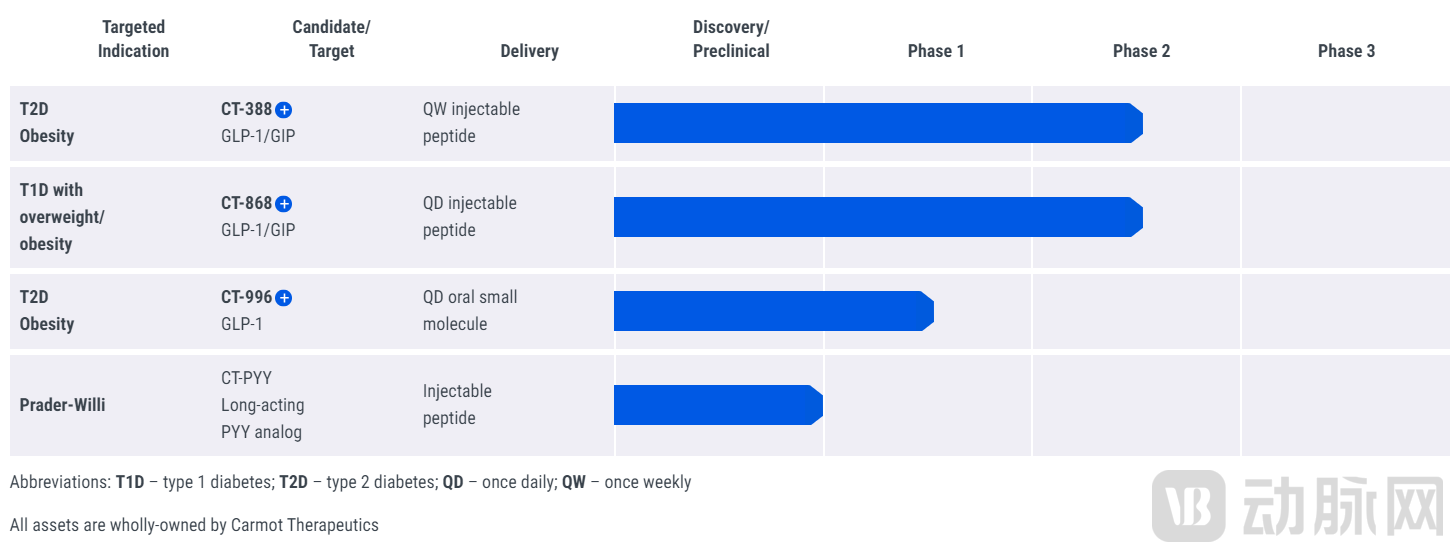 Carmot的在研管线
Carmot的在研管线
图源:Carmot官网
这三款GLP-1药物填补了罗氏在GLP-1赛道的空白,成为公司进军火爆的GLP-1赛道的敲门砖。
但是,自2023年GLP-1异军突起火爆出圈后,尤其是礼来的替尔泊肽(Zepbound)和诺和诺德的司美格鲁肽注射液Wegovy先后获批上市,吸引众多企业入局这千亿市场,后入局者逐渐增多并且争相布局,适应症从糖尿病、肥胖、心血管到慢性肾病,给药方式从注射到口服,GLP-1赛道竞争越来越激烈。
尽管GLP-1赛道“内卷”不断,但拥有获批上市药物的头部企业已赚得“盆满钵满”。根据诺和诺德发布的2023年度财报,公司全年收入约337.71亿美元,同比增长31%,净利润约121亿美元,同比增长52%。其中,司美格鲁肽2023年共取得了212.01亿美元的销售额。值得一提的是,公司GLP-1类产品合计销售额239亿美元,占总营收的70%。
据Global Market Insights预测,全球GLP-1药物市场规模预计将2023年的110 亿美元增长到2030年的500 亿美元。因此,尽管诺和诺德和礼来凭借先发优势垄断了近90%的GLP-1市场份额,并且正在提高产能占领市场,同时多维度提高壁垒稳固护城河,罗氏毅然决然选择入局,以期瓜分这百亿美元蛋糕。
此次给GLP-1“让路”的5款神经类领域在研管线中,包括2款罗氏曾死磕了近18年的AD药物。
2024年1月22日,AC Immune SA(“AC Immune”)宣布与罗氏终止合作协议,AC Immune将重新获得用于治疗和预防AD的2款药物——抗β-淀粉样蛋白抗体Crenezumab和抗Tau抗体Semorinemab的全球开发和商业化权利。
Crenezumab和Semorinemab是罗氏死磕了超10年的AD候选药物。
2006年,AC Immune将其抗β-淀粉样蛋白项目独家授权给基因泰克(Genentech)。根据合作协议,基因泰克向AC Immune支付超过3亿美元的临床和监管里程碑付款(不包括特许权使用费)以获得Crenezumab的相关权益。
2012年,AC Immune与基因泰克签订了第二项全球独家许可和研究合作协议,根据协议条款,AC Immune获得一笔未公开的预付款,并有资格获得针对AD和其他适应症的研究、开发和商业化里程碑付款,总额超过4亿瑞士法郎(按照当时的汇率换算,约为4.18亿美元)。此外,AC Immune有资格获得合作产生的产品净销售额的特许权使用费。
而在2009年,罗氏以468亿美元收购基因泰克,自此,Crenezumab和Semorinemab成为罗氏在AD领域的重点管线。
不过,在罗氏和AC Immune十余年如一日死磕Crenezumab和Semorinemab以来,它们却“辜负”了公司的信任,临床试验遭遇多次失败。
Crenezumab自其被开发以来,开展过8项临床试验,但失败的试验占据一半:2014年,2期临床试验ABBY宣告失败,Crenezumab未能延缓或改善轻至中度AD患者认知减退,错过主要终点。2019年,独立数据监测委员会中期分析表明表示,Crenezumab的两项3期临床试验CREAD1和CREAD 2可能会错过主要终点,罗氏也就此宣布终止这两项试验。
2022年6月,2期临床试验API ADAD宣告失败,Crenezumab未能减缓或阻止AD患者认知能力下降,错过主要终点。2022年11月,两项3期临床试验GRADUATE 1和GRADUATE2宣告失败,Gantenerumab不仅未达到减缓临床衰退的主要终点,β-淀粉样蛋白的去除水平也低于预期。
Semorinemab也不例外。2020年9月,在2期临床TAURIEL中,Semorinemab错过了试验的所有疗效终点,没有改善前驱期或轻度AD患者的预后,自此Semorinemab成为首个临床失败的Tau抗体,被FiercePharma评为2020年世界十大失败临床研究。
2021年11月,在2期临床试验LAURIET中,与安慰剂相比,semorinemab使AD患者认知能力下降的速度降低了43.6%,达到了试验的一个主要终点。但是Semorinemab并未达到另一个主要终点,它对使用ADCS-ADL评估的患者日常功能下降没有产生影响。Semorinemab也没有达到该试验的多个次要终点。
2款药物接连的临床失败让罗氏的希望一点点破灭,产生了剔除它们的想法。不过,Carmot的GLP-1资产弥补了罗氏在神经学和肿瘤领域的空位。
罗氏首席医疗官 Levi Garraway表示:Carmot的GLP-1产品组合提供了不同的给药途径和开发治疗肥胖和其他潜在适应症的联合疗法的机会,并且它们可能是“同类中最好的”,有可能与其管线中的肌肉保护药物一起使用,以及可能用于治疗眼部或脑部疾病的其他用途。
长期以来,AD领域都是新药研发重灾区,研发困难极大。美国药品研究与制造商协会公布的数据显示,在1998—2017年期间,全球已有146个阿尔茨海默病药物在临床试验阶段遭遇失败,强生、辉瑞、礼来、默沙东、百健等制药巨头都在此遭遇过挫折和失败。
据世界卫生组织统计,全球约有5500万人患有AD。AD以及其他类型的痴呆(Dementia)已经成为全球第七大死亡原因。但是据不完全统计,目前仅有8款AD治疗药物获FDA批准上市,但它们仅能改善患者症状,并不能减轻AD的病理变化,也不能逆转或减缓疾病进程。
其中,渤健(Biogen)/卫材的AD药物Aduhelm于2021年6月获FDA批准上市,是近20年来首个被美国FDA批准上市的AD药物。
不过,Aduhelm是一款充满争议的药物,在渤健开启的两项3期临床试验——Emerge和Engage中,Aduhelm显示出相互矛盾的中期结果,在Engage中,主要终点指标没有统计学意义,渤健当时承认Aduhelm的失败,并宣布中止两项试验。并且英国AD协会(British Alzheimer's Association)也对Aduhelm的有效性表示怀疑。
尽管如此,Aduhelm依旧成功上市,但FDA要求渤健需要在Aduhelm上市后进行一项4期验证性研究(Envision研究)。不过,Aduhelm并未成为一个重磅单品。从上市到2021年底,其销售额仅为300万美元;2022年该药的全年销售额为480万美元;2023年前9个月销售额不足1100万美元。
为此,在2022年初卫材首先宣布放弃Aduhelm,将其全权交给渤健。渤健也在近日宣布停止Aduhelm的销售和开发。
但AD治疗药物领域依旧传来了好消息。在宣布终止Aduhelm的销售和开发后,卫材和渤健共同推进另一款AD药物Leqembi的研发。而Leqembi不负其所望,在2023年7月获FDA批准上市,成为20年来首款获得FDA完全批准的AD新药。同时,2024年1月9日,中国国家药监局宣布,Leqembi在中国获批,该药预计将在今年7月中旬在国内上市,用于治疗由AD引起的轻度认知障碍和阿尔茨海默病轻度痴呆。





























