2023年4月20日,跨国制药巨头百时美施贵宝砸下重金,在抗体偶联药物(ADC)领域引进新的研发平台。根据条款,百时美施贵宝支付2275万美元预付款,超10亿美元里程碑金额以及一定比例的销售分成,总金额超10.2亿美元(近20亿人民币)。
事实上,这不是百时美施贵宝第一次在抗体偶联药物领域布局或砸下重金。在2021年6月,百时美施贵宝与卫材就达成全球性合作协议,共同开发和推广靶向叶酸受体α(FRα)的在研抗体偶联药物(ADC)MORAb-202。根据协议,卫材将获得6.5亿美元的前期付款和可达24.5亿美元的里程碑付款,总计31亿美元。
抗体偶联药物的风口来袭,从当前热度来看,颇有PD-1当年的风采。而这些风光,也得益于抗体偶联药物本身显著的临床效果,尤其在肿瘤领域,相比传统化疗,抗体偶联药物还具有毒性更可控、应用范围更广等优点。
与此同时,作眼观全球的跨国药企,百时美施贵宝在2023年初也正面临专利悬崖的困境,这也就是为什么,在同年的JPM大会上,公司传递的发展主题就是努力在专利悬崖背景下实现增长,并宣布将在2022年至2024年期间用约500亿美元现金流加码内外部创新管线。
与此同时,百时美施贵宝表示,多元化是其下一阶段增长的关键,公司也正在推出更年轻以及多样化的投资组合。
这或许解释了2023年4月这起总金额超10.2亿美元的商业合作项目的诞生。
合作协议中的另一方,是一家位于德国慕尼黑的蛋白质-药物偶联开发商Tubulis,通过针对特定靶标定制靶向分子和有效载荷的组合,以开发性能更优越的新型抗体偶联药物。
慕尼黑大学资助,自由程序员和正统学术人的创业
Tubulis两位创始人的职业生涯迥异,不过,造成这种差异的是创始人兼首席执行官的Dominik Schumacher博士那多少有点古怪的职业生涯;相比之下,另一位创始人兼首席战略官Jonas Helma-Smets博士则更偏向于正统的学术人士。
在Helma-Smets还在慕尼黑大学实验室担任博士后研究员时,怎么也想不到未来他不仅转职,还创立了公司,和制药巨头百时美施贵宝签署合作协议,以及,工作地点距离慕尼黑大学实验室仅仅250米的直线距离。
不过,Helma-Smets在职业上已经取得了长足的进步。当时,这位分子生物学家正在研究为位点特异性蛋白质功能化和单域抗体作为细胞生物学应用的新型研究试剂,还有过一次创业经历:一家致力于开发用于蛋白质纯化和超分辨率显微镜的高度特异性抗体的企业ChromoTek,于2020年被抗体标杆性企业Proteintech收购。
此后,或许是眼见科研成果的商业落地正慢慢走上正轨,又或许是不想因此停下探索的脚步,Helma-Smets重归学院生活,继续他的科研学术之业。他没料到,走上二度创业之路的时刻将在几年后来临。
时间追溯回2010年,正至互联网移动端元年,另一位主角,Schumacher却结束了五年零十一个月的自由程序员职业生涯,专心投入在杜塞尔多夫大学化学专业的学习。现在看来,这仿佛是一个预兆,因为随后他进入海涅大学学习经济学,似乎要为后续的创业打下坚实的基础。
Schumacher一路研读,在洪堡大学拿到博士学位后,与同事合作创立了莱布尼茨分子药理学研究所(FMP),与此同时,他也兼任慕尼黑路德维希马克西米利安大学(LMU)一个研究小组的组长。
Helma-Smets没有细说二人的相识经历,但在同一个学术圈内,二人认识的机会依然很多。待Schumacher和Helma-Smets一起讨论后者的蛋白质功能化新技术后,便一起等待这项技术针对一项针对特定酶的关键实验结果。
不久后,他们意识到:这项技术非常有效。
当他们在一起思考目前的发现有哪些应用场景、是否要进行商业落地时,Schumacher的商业教育和Helma-Smets的创业经历派上了用场;同时起到助推作用的,还有慕尼黑大学鼓励创业的环境和创业孵化服务。
值得一提的是慕尼黑大学的创业公司孵化环境。Schumacher和Helma-Smets的创业经历并非个例,而是慕尼黑大学每年衍生出的创业项目之一,且近些年还有增加的趋势。比如慕尼黑大学最新的衍生项目就包括慕尼黑基因中心的创新免疫疗法、商学院的船舶停泊预订平台以及物理学院的超灵敏显微镜。
在这样的背景下,Schumacher得到了他的教授Heinrich Leonhardt的支持,于是和Helma-Smets一起确立了创业目标:开发一种新型的抗体偶联药物。于是,在获得了第一笔启动资金并处理了各种行政手续之后,2019年,Tubulis正式诞生。
Tubulis技术平台
Schumacher和Helma-Smets寻找抗体偶联药物的动机是开辟治疗实体瘤的新途径,以便为癌症患者带来安全有效的治疗。两人认为,尽管目前抗体偶联药物领域的创新已经取得了进展,但依然面临毒性、功效和适应症等瓶颈,而这些未被满足的需求促成了Tubulis的一系列抗体偶联药物技术平台。
根据Tubulis官网介绍,公司当前的系列技术平台有望克服抗体偶联技术存在的局限性:

不依赖于靶抗原的药物毒性,如过早的有效载荷损失和非特异性细胞摄取
通过采用适当的有效载荷类别和正确的药物-抗体比例(DAR)来匹配目标生物学进而限制了ADC的设计空间
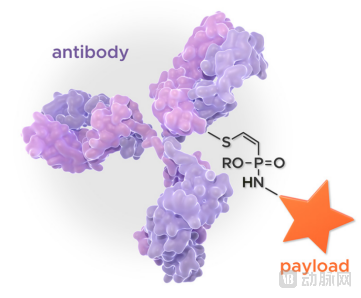
Tubulis开发的P5偶联技术平台可以快速生成前所未有的兼具稳定性和化学灵活性连接子的抗体药物偶联物,从而提供了开发真正差异化抗体偶联药物的机会。
其独特优势包括:
均一性的DAR8偶联比例
化学灵活性和广泛的抗体偶联药物设计可能性
独特的稳定性和选择性
新型的半胱氨酸选择性化学方法
图片来自Tubulis官网
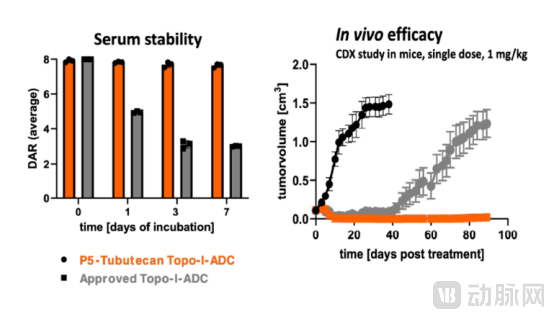
Tubulis专有的连接子-载荷平台提供了优化的强效拓扑异构酶I抑制剂的靶向递送,同时减少不必要的靶向毒性。在不影响整个抗体药物偶联物分子的生物物理特性的情况下实现了稳定和高DAR值(DAR8)的有效载荷附着。
目前已获批的以马来酰亚胺为基础的Topo-I抗体偶联药物,随着时间的推移会失去60%以上的有效载荷,导致三天后的平均药物-抗体比率仅为3。基于Tubulis公司专有的P5偶联技术的Topo-I 抗体偶联药物可在血清中保持稳定的DAR超7天。
基于Tubutecan的ADC的独特特征将转化为持久的体内效力,如1mg/kg单剂量给药就能使所有动物在90天内获得明显的益处和完全缓解。
图片来自Tubulis官网
该技术平台的灵感来自微管生物学,通过调节抗体为有效载荷提供有益的微环境,并为抗体偶联药物候选增加稳定性。偶联采用的是基于微管蛋白酪氨酸连接酶(TTL)的定点偶联,可生成均一、稳定的抗体偶联药物。
此外,由于Tub-tag®技术平台的抗体偶联药物主要为针对不同个体定制,因此有望减少用药后引起不良免疫反应的风险。
其独特优势包括:
同质DAR2或DAR4缀合
具有高DAR灵活性的载药量确定方式
Tub-tag®为特定位点的有效负载缀合提供了有益的微环境
BD+资金:打通供应链和适应症壁垒
除在技术创新方面深耕外,Tubulis团队在产品临床效果和落地方面也毫不马虎。就在公司成立一年后,2020年12月2日,与药明康德子公司合全药业、药明生物建立战略合作伙伴关系,共同加速Tubulis新一代抗体偶联药物的开发,直至新药临床实验申请(IND)。
根据合作协议,药明生物和合全药业将成为Tubulis的CDMO合作伙伴,提供抗体偶联药物产品中间体的规模放大、工艺开发和GMP生产服务,其中合全药业专注于连接体(linker)和有效载荷(payload),而药明生物则专注于单克隆抗体和Tubulis专有Tub-tag®平台中使用的酶。
在合作加持下,Tubulis顺利亮相两年后的第十三届World ADC San Diego 2022(2022年世界抗体药物偶联大会,简称World ADC大会),并发表了有效载荷的相关演讲。
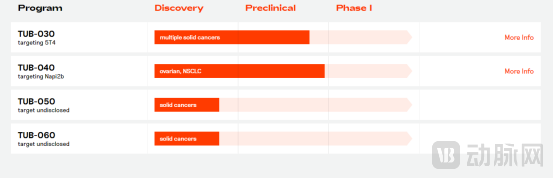
不仅如此,又一个两年后,也就是2024年3月14日,Tubulis宣布成功完成了1.388亿美元B轮融资,以进一步支持其实体瘤抗体偶联药物管线,资金用于帮助TUB-040和TUB-030这两款领先候选药物获得临床概念验证。
其中,TUB-040针对的是肿瘤抗原Napi2b,这是卵巢癌和肺癌中一个特征明确的靶点;TUB-030针对的是5T4,这是实体瘤中经常过度表达的抗原。这两种候选药物的临床前概念验证数据将在4月份举行的美国癌症研究协会(AACR)年会上公布。此外,Tubulis表示,预计将于2024年启动首个1/2a期临床试验,包括剂量升级和剂量优化组群。
图片来自Tubulis官网
此外,此次融资获得的资金还将资助Tubulis扩展其全套技术平台,为开发多功能、可定制的抗体偶联药物提供新的有效载荷。
需要指出的是,近几年抗体偶联药物领域取得的巨大进步主要得益于为特定靶标量身定做的设计。这要归功于探索和验证越来越多的靶标、筛选专用于抗体偶联药物的抗体(重点是交叉反应,利用pH变化有助于与肿瘤的优先结合,促进内吞和FcRn循环)、偶联技术的改进以及有效载荷的多样化。而Tubulis现有技术平台的灵活性预示着抗体偶联药物的“定制”设计开发成为可能。





























