全球最贵药物易主。
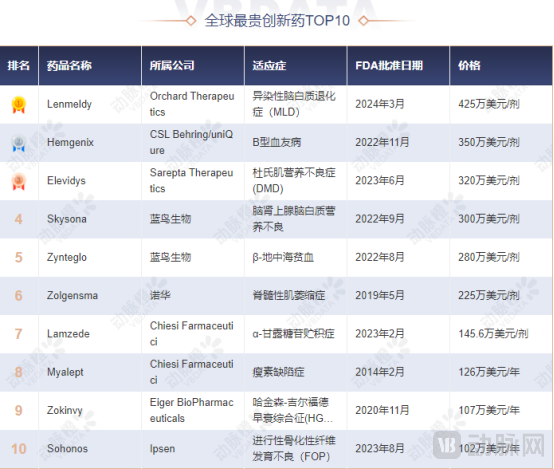
2024年3月18日,FDA批准Orchard Therapeutics研发的基因疗法Lenmeldy用于治疗异染性脑白质营养不良(MLD)儿童患者后,3月20日Orchard Therapeutics宣布其超罕见疾病药物Lenmeldy在美国一次性治疗的批发采购成本(WAC)为425万美元(约3000万人民币),一跃成为有史以来最昂贵的药物。
此外,由于MLD包括前症状性晚发婴儿型(PSLI)、前症状性早发青少年型(PSEJ)或早期症状性早发青少年型(ESEJ)儿科患者。使其成为美国第一个也是唯一一个治疗早发型疾病的疗法。
Libmeldy是一款基于慢病毒体外基因修饰的自体CD34+细胞的基因疗法。其利用含有人ARSA基因的慢病毒载体对自体分化CD34+细胞进行转染,使细胞表达ARSA,从而治疗MLD。Libmeldy通过静脉注射给药。能够通过一次性输注纠正MLD的潜在遗传原因。
在Lenmeldy定价之前,CSL Behring的Hemgenix是世界上最贵的药物,单剂治疗要价350万美元,治疗乙型血友病。再来是治疗肌肉失养症的Elvevidys,要价320万美元;第4名则是Skysona,要价300万美元,用来治疗肾上腺脑白质失养症。
近两年,随着基因疗法的上市,药品价格记录更是不断被刷新。而制药企业给基因疗法贴上高价标签不仅是因为“研发+生产门槛”和“安全性”两大痛点带来的巨大研发制备成本,同时也因为基因疗法的思路是从源头上解决问题,通过调控上游DNA的遗传信息,“纠正”致病基因,进而改变下游蛋白质的表达,因此其具有一次性治愈的潜力。
此外,罕见病也是天价药频繁出现的领域。由于罕见病患者少、市场小,以及开发成本高,药企普遍研发热情不高,不愿意在此投入过多精力,因此企业想获得与常用药物相同的收益,就势必要提高单价。
1Lenmeldy
Lenmeldy的适应症MLD是遗传性疾病,患者先天缺少能分解脂质的酵素“脑硫脂”,使脂质最终对神经造成毒性,会逐渐失去动作和思考能力。罹患这种病的小孩诊断发现后,通常生命不超过5年,多半活不过7岁,美国每年约40名新生儿有这种病。
Orchard在证明价格标签的合理性时表示参考了临床和经济审查研究所(ICER)的评估,该评估将Lenmeldy的健康福利价格基准设定为高达394万美元。这个定价也反映了该疗法可能为符合条件的患者及其家庭带来的价值,以及治疗可能对总体医疗保健利用率、护理人员生产力损失最小化和患者生活机会产生的潜在长期影响。
Orchard Therapeutics表示,首批接受Lenmeldy治疗的病患已追踪超过12年,研究人员持续发现治疗后经过基因改造的细胞,会制造患者体内缺少的酵素。
2Hemgenix
Hemgenix是由CSL Behring和uniQure开发的一款基于腺相关病毒5(AAV5)的基因疗法,2022年11月获FDA批准上市,用于使用凝血因子IX预防性治疗或有严重出血或自发性出血发作的B型血友病患者。
这是全球首款治疗血友病B成人患者的基因疗法。Hemgeni是一款基于AAV5载体的基因疗法,该药物搭载有凝血因子IX(FIX)基因变体(FIX-Padua),通过静脉给药,给药后该基因可在肝脏中表达FIX 凝血因子,分泌后进入血液发挥凝血功能,从而达到治疗目的,理论上一次给药长期有效。
该产品以每剂350万美元的价格在获批后一度位居榜首,直到Lenmeldy。尽管价格高昂,但CSL Behring认为该药物将“为整个医疗保健系统节省大量成本”,并“通过降低年出血率、减少或消除预防性治疗和保持多年的高IX因子水平,显著降低B型血友病患者的经济负担”。
3Elevidys
2023年6月22日,一款Sarepta和罗氏共同开发的基因治疗药物Elevidys获得FDA加速批准,用于治疗杜氏肌营养不良(DMD)患者。此次获批后,该药也成为了全球第一个上市的DMD基因治疗药物。
随后,这款定价为320万美元一个疗程的新药迅速跻身上榜,跻身全球昂贵药物前三名。然而,Elevidys 的面世并没有引起想象中的热烈欢迎,包括 Nature 在内的医疗权威媒体和医学专家对这一药物的前景都持观望态度,研发药企的股价不涨反跌。
问题出在Elevidys的疗效。在FDA关于该药上市的专家咨询委员会会议上,专家们以8-6的比分勉强通过该药加速上市,这使得该药成为了史上唯一一个没有硬性疗效证据,而是通过加速审评程序上市的基因治疗药物。此外,市场对Elevidys能否挣钱的预期也并不乐观。
4Skysona
Skysona于2021年7月获欧盟批准上市,2022年9月获美国FDA批准上市,用于治疗早期脑肾上腺脑白质营养不良(CALD)。
脑性肾上腺脑白质营养不良症是一种X连锁的隐性遗传神经退行性疾病,是肾上腺脑白质营养不良症的一种较为严重的表型,由致病基因ABCD1的突变引起。CALD患者发病通常出现在幼年时期,发病率在1/100,000至1/200,000之间,95%以上为男性患者。若不经及时治疗控制,病情将恶化为神经系统功能的严重丧失,引起沟通障碍、失明,甚至自主运动能力的完全丧失。
Skysona是蓝鸟生物第二款上市的基因疗法,定价为每剂300万美元。蓝鸟生物表示,除了研发成本外,Skysona的制备也要耗费大量人力、物力和时间。比如,从患者体内收集完细胞后生产一剂Skysona需要55-60天。
该药在欧洲上市不到3个月,就宣布由于商业策略原因退出欧洲市场。另外,CALD极为罕见,在美国每年约有50人患病,公司预计每年治疗约10名患者,可见该药物并不能为其带来巨额销售额。
5Zynteglo
Zynteglo是蓝鸟生物研发的首款治疗β-地中海贫血症的基因药物,于2019年获得欧盟批准上市,2022年获得美国FDA批准上市。
与蓝鸟生物的另一款昂贵基因疗法Skysona相似,面临的营收困境也相同。该药物定价280万美元,且若患者两年内因该疗法疗效下降、需要输血治疗,最多可以获得80%退款。不过,其同样因为价格问题已在欧洲撤市。
6Zolgensma
基因疗法容易给业界留下无法盈利的刻板印象,但诺华的脊髓性肌萎缩的基因治疗药物Zolgensma打破了这一点。
一个疗程的Zolgensma定价225万美元,该药上市后第一季度销售额就达到了1.6亿美元,2021年销售额高达13.51亿美元,2022年销售额进一步上涨到13.7 亿美元,甚至比同样治疗脊髓性肌萎缩的口服药物利司扑兰(2022年销售额11.73亿美元)更高。
Zolgensma 之所以如此畅销,一方面因为脊髓性肌萎缩是罕见病中相对常见的一种,患者数量较多;另一方面,Zolgensma治疗较为简单且不良反应较小。
7Lamzede
2023年2月,Chiesi Group旗下凯西制药(Chiesi Farmaceutici)业务部门公司Chiesi Global Rare Diseases宣布,FDA批准Lamzede(velmanase alfa-tycv)用于治疗α-甘露糖苷贮积症(AM)成人和儿童患者的非中枢神经系统表现。与此同时,Lamzede是首款治疗该疾病的酶替代疗法。
不过Lamzede也存在不足——超敏反应,也是最常见的不良反应,包括过敏反应、鼻咽炎、发热、头痛和关节痛。因此,Lamzede的处方信息包括关于可能发生严重超敏反应的黑框警告。
8Myalept
在基因疗法出现之前,Myalept在全球最昂贵药物年度排行榜中一度处于前列。Myalept由Amryt研发,是一款重组人瘦素蛋白类似物,于2014年获FDA批准上市,用于治疗先天性或后天全身性脂肪营养不良患者的瘦素缺乏症。
脂肪营养不良是一种罕见疾病,其特征是皮肤下脂肪组织的广泛丢失,这将导致瘦素激素的缺乏,并导致代谢状况。
目前,因Amryt被Chiesi收购,Myalept为Chiesi Farmaceutici所有。值得注意的是,Myalept是唯一被批准用于治疗瘦素缺陷症的药物,因此价格也呈现逐年升高的趋势。2021年初,Myalept 的标价从每瓶5093美元涨至5297美元,当年销售额达1.41亿美元。而此前,该药物的价格已多次上涨。据Chiesi称,该药单价为5867.52美元/瓶,患者平均每月使用18瓶,即每月的费用为105615美元。不过,具体使用瓶数可能因患者而异。
9Zokinvy
Zokinvy是一种口服法尼基转移酶抑制剂,通过抑制早衰蛋白的异戊二烯化,进而降低早衰蛋白在细胞核中的积累。
该药物最初由默沙东研发,Eiger BioPharmaceuticals于2018年获得许可。2020年,Zokinvy获FDA批准上市,用于治疗哈金森-吉尔福德早衰综合征(HGPS)和早衰样核纤层蛋白病(PL),也是美国第一个用于治疗早衰的药物。
在价格上,尽管Zokinvy的用药剂量取决于身体表面积,但患者通常每天服用约200mg,以50mg胶囊746美元的价格计算,月费用将达到8.95万美元。因此,Zokinvy年费用高达107万美元。
10Sohonos
Ipsen旗下的获批上市药物Sohonos在四年内经历了两项临床试验暂停(clinical trial holds)、一封完整的答复信(CRL,complete response letter)、欧盟委员会的拒绝、另一项适应症的试验被取消,以及多个安全性问题、重新提交和延迟,最终在2023年8月获得了FDA的批准,用于治疗进行性骨化性纤维发育不良(FOP)。
只是山重水复疑无路之后,并没有真正意义上的柳暗花明。
Sohonos的临床数据结果可谓有一些晦暗不明。不仅如此,除了临床终点的选择以及分析手段的使用之外,它还自带一个黑框警告,因为它可能包藏生长板(亦称骺板)过早闭合的风险,这可能导致骨骼畸形和生长发育迟缓;同时还有胚胎-胎儿毒性警告。
不过,Sohonos的适应症——进行性骨化性纤维发育不良影响着美国约400人和全球900人的生活,在美国的定义,属于超罕见病(ultra-rare disease),指的是那些影响总人口比例小于等于五万分之一的疾病。对于这些影响群体极小,但缺乏疗法的疾病,FDA在药物审批过程中采取的态度和标准,是sohonos引发广泛关注的重要原因之一。相比欧盟,FDA保持了更包容的态度。
当前,Ipsen的口服小分子药物Sohonos是第一个也是目前唯一一个FOP治疗方法。大于14岁患者每年的费用约为102万2894美元,小于14岁的患者每年费用约62万2373美元。
基因疗法也带来了另一个问题:药品不断刷新着天价的上限。从100万美元到200万美元再到350万美元/针。全球没有一个国家的卫生系统可以负担起,这些天价药远非普通家庭可以承担,考虑创新支付方案需要提上日程。
眼下,美国CMS(美国联邦医疗保险和医疗补助服务中心)在2024年1月30日宣布了一项新的细胞基因治疗付费方式的探索,其计划使用细胞和基因治疗访问模型:如果基因治疗在长期改善健康结果方面的成功率低于预期,药物制造商将向医疗支付方退还部分治疗费用。协议还将包括其他价格让步,如基于数量的回扣或保证回扣。
后续CMS将代表各州与制造商谈判,以希望这类支付模型对于其它国家地区也具有一定借鉴意义。




























