“争论不是目的,更好的发展才是。”这是启元生物CEO丁师哲在与动脉网交谈时笑着提到的观点。启元生物团队是一个典型的在疫情期间不断发展壮大、并集结了多位具有丰富临床和商业化经验的海归博士团队,包括曾在雅培、安进、第一三共等跨国药企参与多项重磅品种开发的核心成员,团队年轻且多元化。经历过新冠疫情期、团队的组建磨合等,这家成立于2020年末的biotech,其两条核心管线即将完成临床II期试验,近期将启动临床III期试验。
2020年,全球生物医药融资额超过数字健康和器械之和,且大量融资项目聚焦小分子创新药,美股、A股和港股三大股市热闹非凡;在国内,医疗健康融资总额创历史新高,上海等沿海核心城市成为中国医疗健康资本首选地,近十年来融资项目数量首超北京。
听起来一片大好的形势,落到具体的企业乃至个人身上,依然伴随着意想不到的起起落落,对于启元生物和丁师哲而言,也是如此。
产业方资源加持,聚焦自免-皮肤疾病
在中国的人口老龄化问题日益趋显的背景下,与其相关疾病逐渐增多,影响日常生活体验、降低生活质量的疾病得到更多关注,随着人民生活水平的提高,展现出巨大未被满足的临床需求。与免疫系统相关的皮肤疾病,现有治疗药物多数只能短暂缓解症状,易复发且无法长期使用,如糖皮质激素类药物,大分子则需要通过院内注射,存在使用便利性问题,且长期使用会出现耐药。
启元生物是一家以市场为导向,专注于皮肤及自身免疫疾病创新药物开发的全产业平台公司,由维眸生物与贝达生物医药产业基金于2020年底共同发起创立。设立启元生物的想法甚至可以追溯到贝达生物医药产业基金成立、维眸生物创立的2016年。
一方面,沈旺博士创立维眸生物时再三思虑,决定专攻眼科疾病,而自免和皮肤科的相关产品管线,计划合作组建专业团队共同开发;另一方面,随着近年来,贝达药业在发展自身同时,也在积极打造贝达产业生态,以贝达基金与贝达梦工场为纽带,为创新企业增效赋能。在这个契机下,启元生物正式创立,并将由沈旺博士主导设计、仍处于PCC(临床前候选化合物)阶段的多条管线快速推进至IND阶段。2021年底,QY201首个IND获CDE批准并完成首例受试者入组,至此,启元生物正式迈进临床阶段。
口服+外用多种给药途径开发,最快管线即将进入临床3期
当时,JAK抑制剂领域辉瑞、礼来、艾伯维等MNC已经抢先布局,国内亦有不少biotech入局,市场价值被证实的同时也面临激烈竞争。“但我们非常看好沈旺博士设计的‘新一代’JAK抑制剂,这也是启元生物目前在研的重点产品。”丁师哲说。
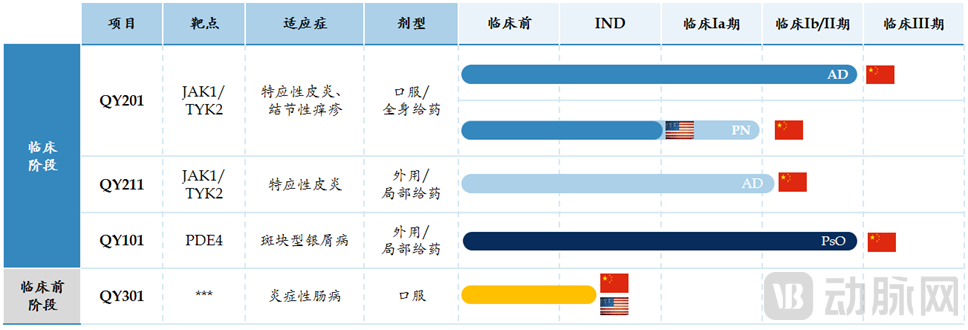
启元生物管线进展 图源:启元生物
启元生物开发的产品在靶向的选择性和活性上进行改进。进展最快的管线QY201是JAK1/TYK2双靶点抑制剂,对中重度特应性皮炎的2期临床试验即将完成,预计将于近期启动临床3期。
JAKs属于酪氨酸激酶家族,包含JAK1、JAK2、JAK3、TYK2四个成员。其中JAK1、JAK3更多负责免疫调节,而JAK2主要与红细胞和血小板的生成相关。为了改进第一代JAK抑制剂不良反应较大的缺陷,第二代JAK抑制剂诞生,并主要针对JAK1、JAK3,,但依然存在潜在的安全性隐患。
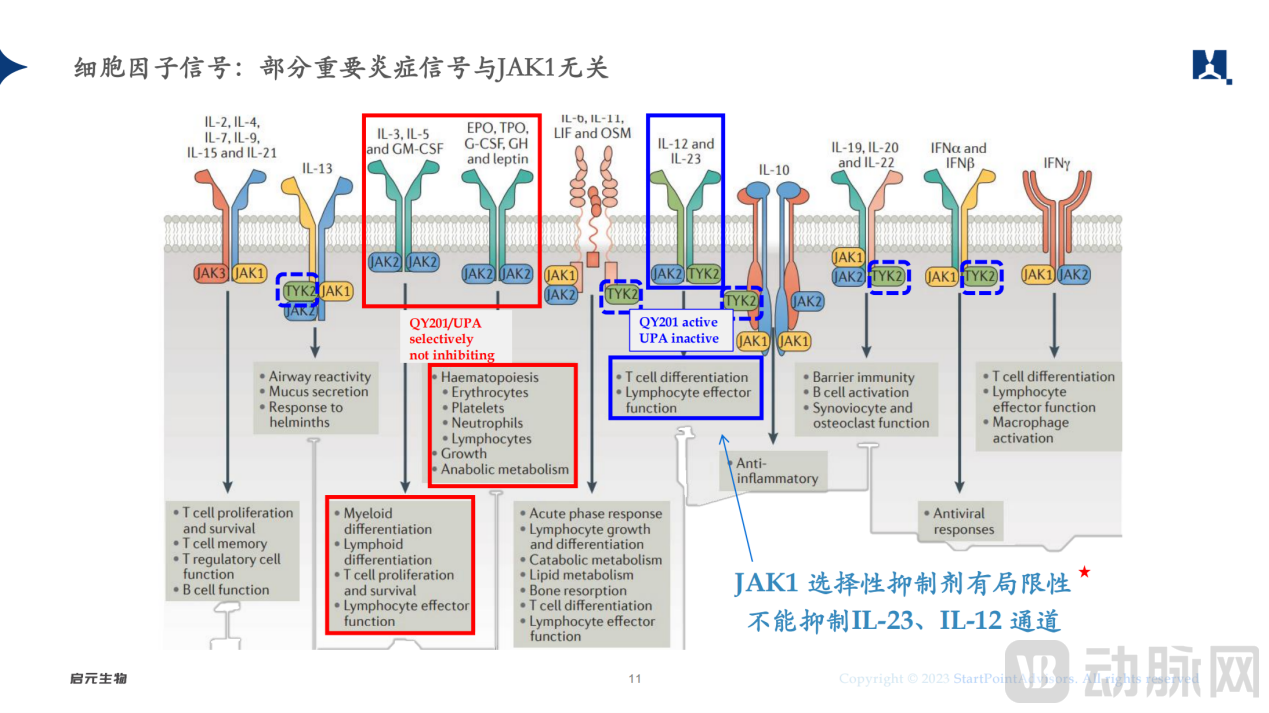
单独靶向JAK1的局限性 图源:启元生物
生物制药行业开始把目光瞄准在免疫过程中起着至关重要作用的TYK2,研究表明,TYK2在调节IL-23、IL-12和1型IFN等细胞因子时,具有很好的安全性。
与其他JAK抑制剂相比,启元生物的QY201同时具有更高的JAK1/TYK2抑制活性和选择性;在酶水平上,对JAK1和TYK2的活性达到皮摩尔级别;在细胞水平上,对JAK1的选择性比JAK2好300倍以上;通过临床前头对头的比较,QY201表现出的活性显著优于同等剂量下的上市药物。
安全性方面,QY201能有效解决非选择性JAK抑制剂的副作用问题(包括感染、贫血、中性粒细胞减少症、淋巴细胞减少症、血小板减少症等)。
在皮肤科领域产品布局上,除了首个获批IND临床批件的口服药物QY201外,第二个获得IND批件的药物QY101是一款外用软膏,是非激素、非甾体类抗炎的磷酸二酯酶4(PDE4)抑制剂。目前QY101临床II期试验即将完成,近期将启动临床III期试验。
PDE4是治疗炎性皮肤疾病的高潜力靶点,目前围绕该靶点开发的产品疗效和安全性难以达到一个较好的平衡点,亟需新一代产品。据启元生物介绍,QY101多个分子特性指标相比竞品优势明显,临床前试验结果显示,其具有良好的局部吸收特性和系统内快速降解能力。
提及两条管线的开发过程,尤其是QY201的进度推动,丁师哲用了“惊心动魄”来形容整个过程的挑战性。QY201在临床I期的时候正值国内新冠流行,在临床PI的帮助和团队的努力及经验下,QY201临床I期患者未有脱组情况,如期完成。
“在竞争激烈的赛道中,我们需要尽快、尽早地得到临床的验证。” 丁师哲介绍,得益于这样的理念,公司团队后期凭借超强执行力,秉承效率优先的行事风格,高效地完成了QY201在中重度特应性皮炎适应症的Ib/II期临床患者入组。
积极布局海外市场,QY201已获FDA临床批件
2023年07月26日 ,启元生物收到了美国FDA对QY201的IND的批准,这是启元生物获得FDA的第一个临床批件,也是启元生物首个独立自主申报的美国IND,标志着启元生物QY201片出海计划正式启航。
纵览启元生物的管线进展,会发现临床前阶段的管线采用了中美同步推进的策率,这与此前曾在贝达药业深度参与多起BD合作交易的丁师哲密切相关。“启元生物创办初期,就对海外拓展与交易十分重视。”
不过,与“再不出海中东就晚了”或东南亚出海热潮所宣扬的不同,启元生物首先看重的是发达国家市场。“结合启元生物的专攻领域,皮肤科疾病和自免疾病的发病率在发达国家会更高;此外,由于发达国家的生活水平整体更高,患者对日常生活质量的重视度也随之上升。因此,相比阿拉伯或东南亚市场,皮肤病相关疗法在以美国为代表的发达国家更有市场号召力。”丁师哲补充道。
在出海战略的推动下,有效的临床验证和更高的性价比就成为了启元生物要继续探索的命题。经历过寒冬困境的考验,公司更为坚定的相信,现在的挑战终将成为启元生物未来出海目标的实现和产品商业化落地的底气与动力。





























