2023年底,全球首款CRISPR/Cas 9基因编辑疗法获FDA批准上市。同月,其背后母公司之一Vertex Pharmaceuticals宣布将向张锋创立的基因编辑疗法开发公司Editas Medicines支付1亿美元,外加潜在许可费,以获取其CRISPR-Cas9基因编辑技术的非独家授权。此外,Editas还有机会在2034年专利到期之前,每年获得1000万-4000万美元的专利许可费。
考虑到Vertex在2023年从CRISPR Therapeutics获得Casgevy授权时,已支付了CRISPR Therapeutics 2亿美元的里程碑付款,Vertex这款年产能在数百人级别的自体细胞治疗产品为使用CRISPR-Cas9基因编辑技术向两家专利拥有方支付了可观的专利费用。
巨额专利许可费背后是CRISPR/Cas9基因编辑疗法面临的重重专利挑战。
一方面,Cas9专利保护范围极广,无法通过突变、调低序列相似度或发现新的Cas9蛋白绕开,且底层专利尚未达成交叉授权,存在多头收费问题。同时,专利壁垒已覆盖全球,加州大学、Broad研究所、Toolgen等机构在中国也同时拥有底层专利。另一方面,2012年衍生至今,Cas9系统包括近3万个专利,所属专利家族为8000余个,覆盖了各类改良突变体、新型工具、疾病治疗位点、不同物种、递送工具和应用方法,后续新型编辑器的结构专利往往也与Cas9系统直接相关。
交叉专利、多重付费、专利丛林均为CRISPR/Cas9技术及衍生工具的商业化使用搭起高墙。那么,体内基因编辑与基因疗法的未来可能性在哪里呢?其中一个答案是,依靠AI技术与蛋白进化,独立构建绕开底层专利的自主技术平台。
微光基因(苏州)有限公司(以下简称“微光基因”)2021年成立,以新型基因编辑工具和细胞基因治疗方法开发为支点,致力于新型基因编辑技术的研发与产业化。成立以来,微光基因团队已经在新型基因编辑工具及递送系统方面提交了十余项发明专利。2024年1月5日,微光基因科学团队自主研发的“工程化的腺苷脱氨酶及碱基编辑器”正式获得国家知识产权局(CNIPA)专利授权,是国内最早获得自主知识产权碱基编辑器专利的公司之一。

(受访者供图)
近期,微光基因已经和两家物种改良企业、多家细胞治疗企业签订协议,已有多项合作落地。作为国内极少数拥有Cas蛋白、碱基编辑器、表观编辑器、VLP递送系统基础知识产权的企业,微光基因如何搭建多个自主研发新型编辑器技术平台?又将如何探索CRISPR基因编辑技术的临床应用与商业化路径?对此,动脉网采访到了微光基因CEO胡洋博士。
 胡洋博士曾就读于中山大学松阳洲教授实验室,专业方向为基因编辑/衰老研究。曾任中信投行部高级副总裁、广发证券投行部医疗健康联席总经理。
胡洋博士曾就读于中山大学松阳洲教授实验室,专业方向为基因编辑/衰老研究。曾任中信投行部高级副总裁、广发证券投行部医疗健康联席总经理。
动脉网:微光基因的创立是基于什么样的研究、观察和契机?
胡洋:我们的创始人、首席科学家松阳洲教授长期专注于蛋白质功能、细胞衰老以及细胞再生调控机制领域的研究。2009年,松阳洲教授回国,任中山大学生命科学学院院长。回国后,教授重点建设了蛋白相互作用发现平台和蛋白功能发现平台。自此时起,教授的实验室就已经开始在基因编辑技术和方法上进行探索,并建立了基于基因敲除的动物蛋白功能发现平台。
2013年,实验室已经应用CRISPR基因编辑技术进行研究,也是全球最早将此技术应用于罕见病治疗探索的团队之一。2015年,松阳洲教授带领的团队在全球首次于人类胚胎中利用CRISPR/Cas9技术编辑地中海贫血的突变基因HBB。因为实验室更加关注于常见难治性疾病,所以在2016年起,团队即开始关注表观遗传工具的开发。2020年,松阳洲教授课题组在Nature Communications发文,开发了以type I-F CRISPR-Cas系统为基础的哺乳动物高效转录激活工具,为哺乳动物细胞的基因表达调节提供了新的工具。
2021年,基因编辑疗法在全球研发环境和商业化机会逐渐明朗,所以我们成立了专注开发自主基因编辑工具和体内基因疗法的微光基因,并在2022年完成了杏泽资本领投的近亿元天使轮融资。
动脉网:微光基因如何将体内基因编辑疗法及自研工具平台确定为主要研发方向?
胡洋:2022年左右,微光基因有一个重要的布局调整,就是战略性停止了体外基因编辑技术平台的管线跟随,重点去突破和搭建具有自主知识产权的底层技术平台,并将目标锁定为体内基因疗法管线开发和体外细胞编辑的技术授权。
体内基因编辑,相对细胞编辑来说更像常规意义上的药物。对于自体定制化产品而言,制造和运行成本非常高,产能和需求端又比较有限,后期商业化的挑战对于Biotech来说比较大。但是相对应地,体内基因编辑在工具本身和递送系统上存在一些最核心的瓶颈,还需要技术上的不断突破,我们团队本身的禀赋主要在技术创新与改进,而不是靶点Fast Follow的临床开发,所以我们最终选择了技术难度和未来空间相对更大的体内基因编辑及自主技术平台开发路线。
到目前为止,基因编辑疗法还处于非常早期的状态,第一批靶点的验证性价值比商业化价值更高,适应症以严重的罕见病为主,但单一靶点、单一罕见病适应症下的适用患者非常少,边际成本很难降下来。同时,为了求“快”,很多Biotech会直接应用仍在专利期间的基因编辑工具和海外公司已经验证的罕见病靶点,后续再考虑置换或者商业化问题。但专利付费或是工具置换都意味着潜在的时间和金钱成本,加上Cas9技术特殊的多重底层专利纠纷及付费门槛过高的问题,对于大部分Biotech来说,都是不可承受之重。同时,这样的策略也和“Fast Follow”药物研发中需要特别关注的专利到期时间以及选择大适应症的原则有所冲突。
此外,单碱基编辑器和表观遗传编辑器在体内不会造成双链切割,风险更小、更低;安全性和递送效率都更好的VLP递送系统是为了突破现有递送工具的适应症瓶颈。我们做的多款工具平台都是为后续体内管线布局服务的,更适合做一些非罕见病、严重程度相对较低、需要长期甚至终身治疗的大病种。比如退行性病变,某种程度来说与罕见病有相似性,在一定的年龄或诱发因素下发病,针对位点和基因不同,且一旦发病多为终身服药。
基因编辑疗法的长效性和精准性则恰好可以解决这些问题。碱基编辑和表观遗传编辑技术会更适合非罕见病,因为它基本上不对DNA做特别大的改动。特点就是可以低风险、超长效、高精度地去调控基因。在多基因调控和更精确的编辑上,碱基编辑和表观遗传编辑这类新型编辑技术也相对更有优势。
在全球范围内,我们也观察到,自研基因编辑工具、VLP递送系统的Biotech在近3年内逐步被认可,比如去年全球最大的种子轮——融了1亿美元的Nvelop Therapeutics。
动脉网:基因编辑技术的核心优势在哪里?又有哪些痛点阻碍着基因编辑的发展?
胡洋:基因编辑其实已经是从发现到药品上市发展最快的一个新技术。这是好事,说明了它确实是一个差异化的技术平台——在调控基因的精准度和长效性上是目前最好的,具有成为罕见病领域终局化工具和非罕见病长效药物的潜力。
对于国内基因编辑企业而言,底层专利的限制是核心痛点之一。基因编辑领域范围最广泛的底层专利技术发现日期较近,距离过期还有相当长的时间,费用昂贵且未达成交叉授权。除了2033年12月到期的几个底层专利,衍生专利众多,到期时间也将不断被拉长。
在现实逻辑上,底层专利的阻碍会极大影响后续临床管线的交易和商业化。MNC和大型药企很难在Biotech未拿到授权、存在明确知识产权风险的情况下达成合作授权或引进。巨大的专利沉没成本会影响后续的商业收益,承担归零的风险。专利成本也最终会转化为药物的前端成本,成本收不住,价格打不下来,产业化也会出现问题。只有解决专利问题,才可能在全球市场去跟(基因编辑工具)原研方的孵化公司竞争,获得更广泛的商业化可能性。
另一个体内基因编辑领域更核心的痛点是递送问题,不管基因编辑工具有多精准或者高效,如果我们无法准确地将其递送至目标组织或者细胞,都无法开发出有效的基因编辑药物。现有的常见递送工具如AAV、LNP在递送基因编辑工具上都存在比较大的限制,递送器官主要局限于眼睛及肝脏,且存在递送工具大小、毒性剂量限制等问题,这是目前体内基因编辑疗法最大的瓶颈限制。
基于这些问题,微光基因选择了先建设起自主知识产权的编辑工具及能与之更好适配的递送工具等创新性技术平台。
动脉网:目前,微光基因的团队构架和平台研发进展如何?
胡洋:我们目前整个团队在30人左右,其中研发成员超过20人,团队中有9名博士。大部分成员拥有非常丰富的细胞及基因编辑、蛋白质、衰老等领域的研发经验。同时我们也希望这个团队能够迅速适应后期的产业化,所以各部门总监都有大型医药企业相关经历,具有丰富的产业化经验。
目前,微光基因已经自主研发出基因编辑/表观遗传工具包,具有底层自主知识产权、可在全球自由实施。在单碱基编辑器上,微光基因是国内最早一批拿到自主研发专利的,且效率媲美国际顶尖水平。在表观遗传编辑器上,我们是国内为数不多的能做到底层专利干净、效率与原研媲美的团队。同时,我们还布局了结构独创、自有底层专利的VLP递送系统,安全性及递送效率媲美Nvelop的eVLP。
再往底层追溯,基因编辑工具包也是基于微光基因自有的、全面的蛋白质结构分析、理性设计及定向进化平台。我们应用各种AI工具去做蛋白的理性设计与功能化改造,逐步将其应用效率、耐受性提升至全球前沿水平。基因编辑工具中应用的酶,也是沿着这一路线进行研发的。
总的来说,从2022年上半年成立至今,我们已经搭建好一体化工具平台,摸索出绕开专利壁垒和递送限制的路径,在进一步开发差异化且商业化逻辑更好的适应症。
动脉网:自主研发的基因编辑工具,有哪些关键节点和挑战呢?
胡洋:做自主研发的工具,关键是其效率水平不能降低,风险不能增加。我们不能因为追求知识产权的突破而降低药物本身的质量,这为工具开发提出了很高的要求。
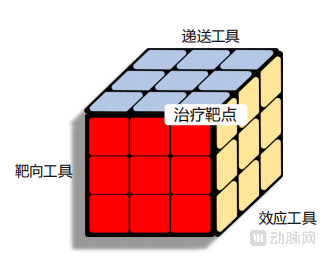
体内基因编辑药物好比魔方,是一个非常复杂的药物系统,要求递送工具、靶向工具、效应工具三者互相适配,针对一个合适的治疗靶点,才能够做出一个好的、成功率高的药物。我们在早期管线开发时做到好的平衡设计,后期的临床开发风险才能大幅降低。
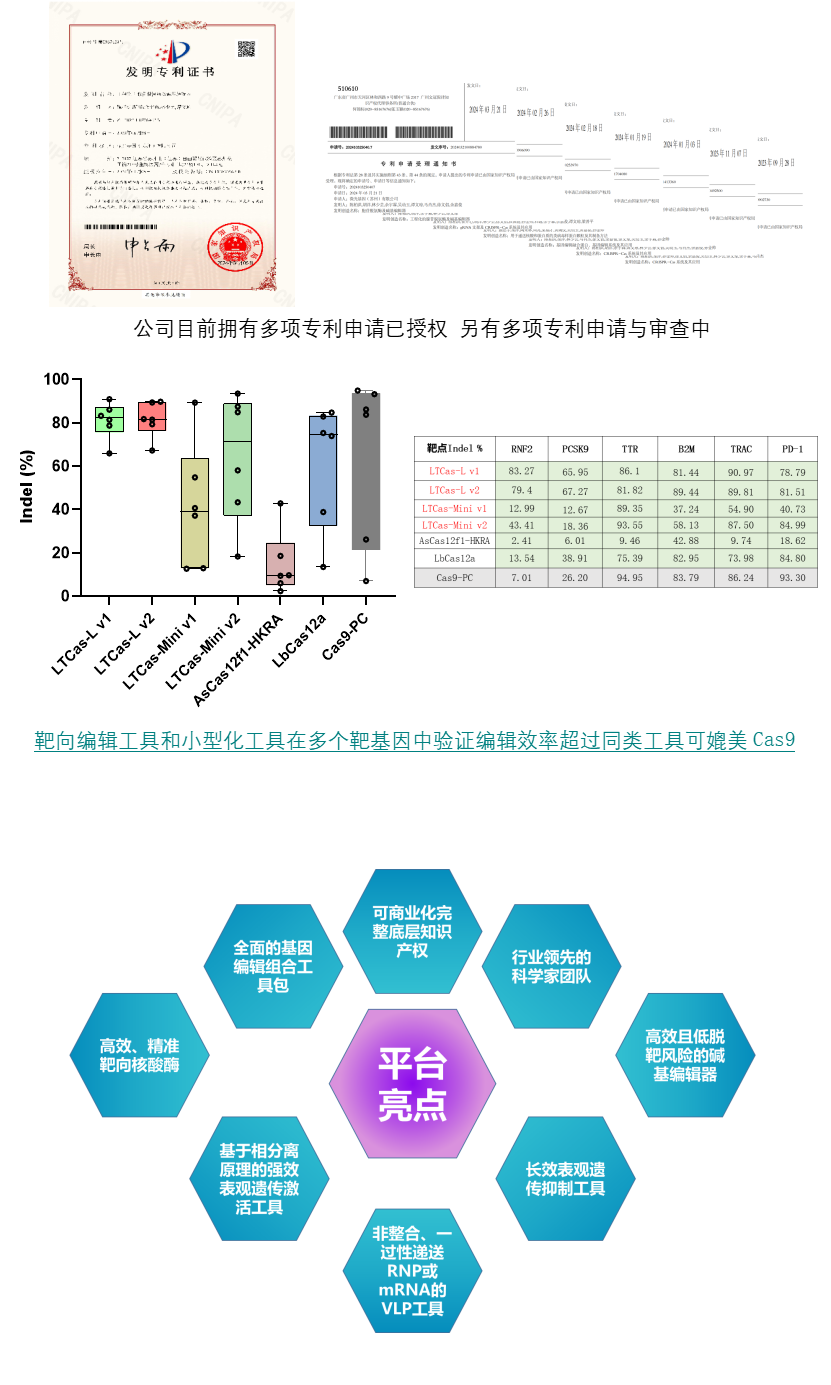
靶向工具上,自主Cas蛋白定位DNA序列,并实现双链切割。常规大小工具LTCas-L切割效率,很多测试位点效率优于Cas9,达到行业顶尖水平;小型化工具LTCas-Mini切割效率强于同类Cas12f小型化工具,多个位点效率国际顶尖。目前均已完成FTO报告和专利申请。
效应工具上,我们成功优化出新型长效表观遗传抑制器、抑制率达到90%以上的多种长效抑制器组合,并已在多个非罕见病靶点上进行了测试。碱基编辑器编辑效率媲美ABE8e,脱靶明显优于ABE8e,且已获得国家发明专利授权,已完成FTO报告。
递送工具上,微光基因研发了结构独特、自有底层专利、全球无专利限制的VLP递送系统。数据显示,与明星公司Nvelop的eVLPs相比,微光基因的LT-VLP在保证了安全性的同时,提高了包装滴度和编辑效率;主动靶向能力强,拥有更高的递送和编辑效率,总体编辑效率超过90%;且骨架和包膜来自人类共同进化的病毒种属,免疫原性较低。
动脉网:当底层工具平台逐步搭建和完善后,微光基因有哪些推进中和潜在的商业化机会?
胡洋:首当其冲的是Cas蛋白的对外技术授权。成本可控的基因编辑工具知识产权是体外细胞治疗企业、物种改良企业的刚需产品。从实验数据和客户的使用情况来看,微光基因的Cas蛋白效率上已经达到国际一流水平。我们正在积极推进公司工具的对外合作,愿意为需要使用基因编辑的企业提供可自由使用的、最划算的工具,极大幅度地降低基因编辑商业化门槛,解决知识产权的“卡脖子”问题。
除此之外,我们的新型基因编辑工具如碱基编辑器和表观遗传编辑器,在多基因同时抑制等方面有着极大潜力;VLP递送系统在原代细胞安全高效编辑等方面优势明显,我们也正在努力推进这类新型工具的对外合作。
随着技术平台成熟,我们已经开始多条管线的临床前药理、药效与安全性评价测试。因为靶点明确、平台精准度高,我们预期管线在今明两年会在人用数据上快速推进。对应管线进展,我们也会积极对外寻找具有临床及成药经验的企业进行合作授权。
在更广泛的范围内,我们观察到全球新型基因编辑工具同样在加速发展,并已经获得了MNC的技术授权合作单:比如2024年再生元(Regeneron)和Mammoth Biosciences宣布达成一项预付款款项达1亿美元的合作协议,2023年礼来与Scribe价值15亿美元的Case12e蛋白技术授权。单个新型基因编辑工具即可获得数亿美元对价,这意味着基因编辑已经进入了百花齐放的新阶段。
过去大家可能认为,基因编辑已经足够革命性。现在发现,至少在医学应用上,与之适配的递送工具的重要性可能很高,可以让基因编辑充分发挥其潜力,拓展到罕见病之外的大病种治疗领域。所以,行业顶尖的团队都在寻找新的递送工具,并开发更高效精准的编辑工具,让摩方上的每一面都更加适配未来的基因编辑药物。





























