7月16日,韩国药企Orum Therapeutics宣布,与Vertex Pharmaceuticals达成了一项全球性多靶点研发和许可协议,根据该协议,Vertex有权使用Orum的双精度靶向蛋白降解(TPD²)技术平台,以发现用于基因编辑治疗的创新预处理药物(conditioning agents),将共同开发
至多3款抗体偶联蛋白降解剂(DAC)药物。
根据协议条款,Vertex将支付1500万美元预付款,以及每个项目3.1亿美元里程碑金额,合作总金额高达9.45亿美元。
独有技术平台,1亿首付授权BMS一款FIC药物
靶向蛋白降解(TPD)是一类小分子药物,利用细胞正常的泛素-蛋白酶体机制,来降解以前 "无法药物治疗 "的靶点,从而达到治疗效果。
但Orum认为传统靶向蛋白降解剂通常是小分子,会不加区分地进入全身的许多细胞,而传统ADC需要被细胞表面受体内化,因此受到细胞表面靶标及其表达水平的限制,进而受限于某些适应症。基于此,Orum开发了独有的TPD²平台,将蛋白降解与ADC技术结合起来,依赖抗体偶联递送小分子靶向蛋白降解剂进入到肿瘤内部进行作用,开发出创新的、一流的、具有肿瘤选择性的新型靶向蛋白降解剂(TPDs)。这类TPDs可将有效载荷一端与抗体结合,特异性地输送到癌细胞,另一端通过 E3 泛素连接酶途径特异性地降解癌细胞内的目标蛋白,并导致肿瘤细胞死亡。
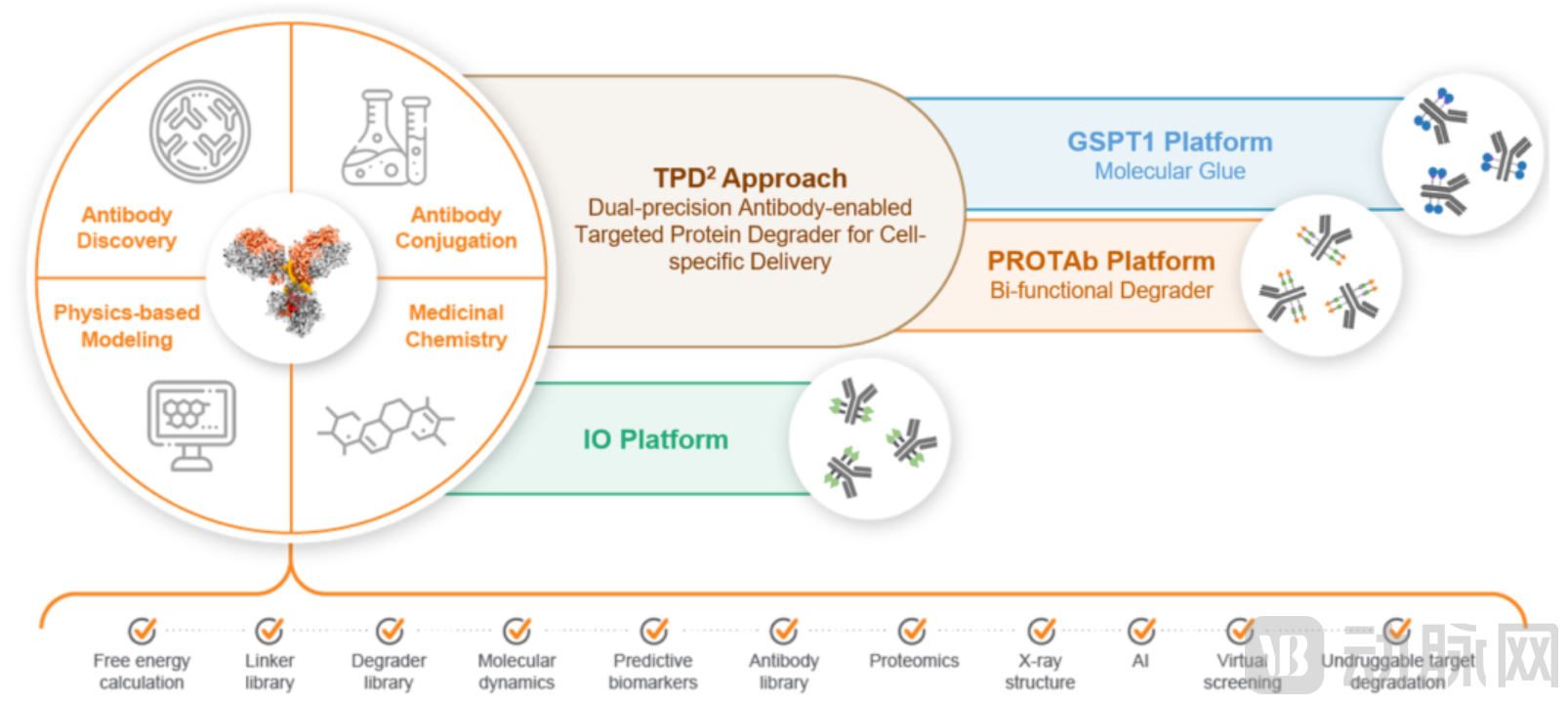 TPD²平台 图源:Orum官网
TPD²平台 图源:Orum官网
据Orum官网披露,TPD²平台的优势如下:
有效性:临床前实验证明,通过抗体介导的递送方法,蛋白质降解剂的效力可提高 1000 倍。
安全性:抗体偶联降解剂在被内化并从抗体中释放出来之前没有活性。这些抗体的内化依赖于与特定细胞表面抗原的结合,从而减少了非目标细胞对蛋白降解剂作用的暴露。
药代动力学和药效学:将小分子蛋白降解剂与抗体耦合可增加有效载荷的半衰期和药物暴露量
2023年11月6日,百时美施贵宝(BMS)宣布以 1 亿美元首付款引进Orum的一款FIC候选药物ORM-6151。ORM-6151是一种抗CD33抗体降解剂偶联物,在FDA批准下正在开展临床I期试验,针对急性髓性白血病患者和高危骨髓增生异常综合征患者。
此外,Orum通过TPD² GSPT1平台开发的另一款候选疗法还有ORM-5029,正处于1期临床试验中,靶向乳腺癌患者中表达HER2的实体瘤,同时Orum还搭建了TPD² PROTABB 与TPS² Cbl-b两类开发平台,相关管线均处于发现阶段。
 Orum管线 来源:Orum官网
Orum管线 来源:Orum官网
蛋白降解+ADC势头崛起,Vertex押注抗体内吞
Orum之外,2023年还有两项DAC药物的开发合作达成,分别是Nurix牵手Seagen和默沙东牵手C4 Therapeutics。其中,C4T先后与国内外企业达成8笔交易合作,其中包括默沙东、德国默克、罗氏、渤健、贝达药业等,累计总交易金额高达48.13亿美元。
而Vertex与Orum合作的深意,除了找寻开发新的药物外,还看上了ADC的抗体内吞效果。去年3月1日,Vertex同样跟ImmunoGen达成合作协议,ImmunoGen授权Vertex使用ImmunoGen的ADC技术用于基因编辑的新型靶向调节剂的开发研究。首付款同为1500万美元,里程碑付款为3.37亿美元。
抗体内吞,是指在细胞表面的抗体与相应的抗原结合后,通过自身分子运输体系,将抗体和抗原复合物带入细胞内部,并在内部起到特定的生物学作用。ADC药物内化途径可根据是否依赖网格蛋白分为两类:一是网格蛋白介导的内吞作用(CME);二是网格蛋白非依赖性内吞作用。其中,网格蛋白非依赖性内吞作用会进一步分为小窝蛋白介导的内吞作用、小窝蛋白非依赖性载体蛋白/GPI锚定蛋白富集的早期内体区室 (CLIC/GEEC) 和巨胞饮作用。
而抗体作为ADC药物的“导弹”,具有靶向功能,可以特异性识别肿瘤细胞表面抗原,与细胞表面抗原结合后发生内吞,将细胞毒素带到肿瘤细胞并发挥毒性效应。
不过,抗体内吞效果往往取决于两个重要因素,一是抗原的表达量,二是抗原本身的内吞能力。对于已经找到两种不同平台合作的Vertex来说,在第一个CRISPR基因编辑基因疗法Casgevy获批之后,探索新的药物领域还需要更多时间验证。
参考资料:
不要过高期望抗体的内吞作用,谈Vertex斥资9.45亿美元与Orum合作开发3款DAC.Antibody Research




























