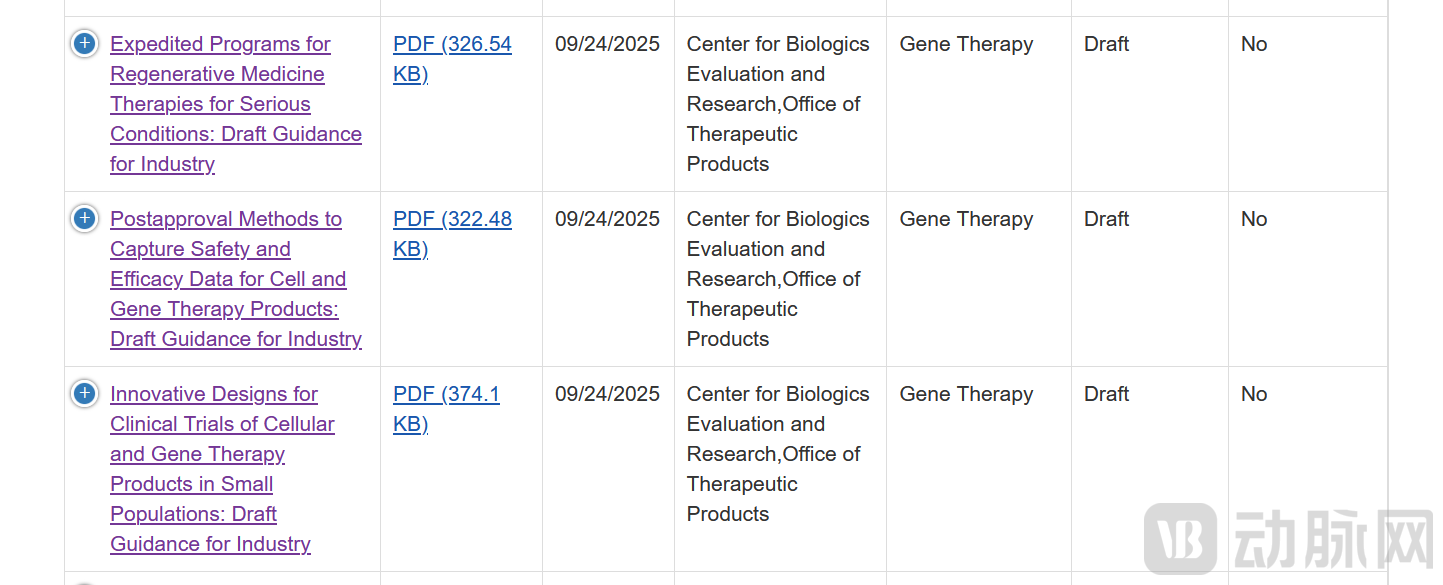
9月24日,美国食品药品监督管理局(FDA)连续发布三份指南草案,旨在为针对小患者群体的细胞与基因治疗(CGT)产品开发、再生医学疗法的加速审批,以及药品上市后安全性与有效性数据收集提供明确指导。
近年来,CGT领域发展迅猛,尤其在肿瘤、遗传性疾病、罕见病等领域展现出突破性潜力,多款CAR-T、基因编辑疗法相继获批,推动治疗模式从传统症状控制向根源性治愈转变。
然而,由于患者人群小、疾病异质性强、长期随访难度大等问题,CGT产品的临床开发与上市后监管仍面临诸多挑战。
FDA此次更新3份指南草案,不仅回应了行业对灵活审评路径的迫切需求,也为全球监管机构在CGT证据生成与全周期管理方面提供了重要参考。
 来源:FDA官网
来源:FDA官网
小群体细胞与基因疗法临床试验创新设计

在《小群体细胞与基因治疗产品临床试验创新设计(Innovative Designs for Clinical Trials of Cellular and Gene Therapy Products in Small Populations)》指南草案中,FDA指出,罕见病药物及生物制品开发常受限于患者群体规模小、可用于支持监管决策的数据有限、疾病自然史认知不足、致病机制理解不全面,以及分子与表型异质性等问题。
上述挑战在细胞与基因治疗(CGT)领域尤为突出,因其还涉及独特的产品生产工艺要求,以及非临床药理学和毒理学证据的生成难度。

然而,CGT产品在罕见病治疗中展现出独特优势,可通过基因校正或修饰实现精准治疗,并支持个体化治疗方案。
FDA强调,在产品开发早期引入创新临床试验设计,有助于优化数据质量,充分挖掘每个数据点的科学价值。
目前,对严重及致命性疾病有效疗法的需求迫切,FDA鼓励申办方在小群体研究中采用兼具创新性与科学严谨性的试验设计,特别是在终点选择上需兼顾可行性与证据强度。
为此,该指南草案系统梳理了六类可供考虑的创新试验设计方案:
单臂试验:通过比较患者在接受治疗前后特定指标的变化来评估疗效,适用于基线数据完整可靠的情况。FDA提示,此类设计在退行性疾病且干预预期可带来改善时较为适用;但在疾病进程波动或治疗目标为延缓进展时,需警惕“均值回归”等偏倚风险,并建议选用客观、非依赖患者主观努力的终点指标。
疾病进展模型:作为定量分析方法,该模型整合生物标志物轨迹、临床终点与患者异质性等因素,模拟疾病自然史以支持试验设计。但关键挑战包括患者间变异度高、观察周期长、标准治疗变迁的影响,以及模型在不同亚群中的验证难度。
外部对照研究:利用历史数据或真实世界数据作为对照,需确保试验组与外部对照组在基线特征、疾病严重程度等因素上高度匹配,并注意数据收集方法、终点定义等方面的一致性。
适应性试验设计:允许依据累积数据对试验方案进行预先设定的调整,从而提高资源利用效率与研究成功率。FDA强调,此类设计需在试验前周密规划,确保修改过程透明、统计严谨,以维护试验整体性与结果可信度。
贝叶斯试验设计:贝叶斯方法可整合外部临床数据,增强并发对照或减少样本量需求,特别适用于罕见病背景下的证据整合。
具有主方案的试验:支持在同一试验中纳入不同疾病表现的研究队列,有助于应对临床表现高度异质性的疾病环境,提高研究效率与数据可比性。
产品获批后安全性及有效性数据收集

另一份《细胞与基因治疗产品安全性及有效性数据的批准后获取方法(Postapproval Methods to Capture Safety and Efficacy Data for Cell and Gene Therapy Products)》指南草案,则旨在指导申办方系统收集CGT产品获批上市后的真实世界数据,以弥补上市前临床研究样本量有限、观察周期不足的局限。
草案指出,由于多数CGT产品在上市前临床研究中纳入患者数量有限,长期安全性和疗效数据往往不充分。因此,批准后研究成为全面评估产品风险与获益的关键环节。系统收集上市后数据不仅有助于深入理解CGT产品的长期疗效持久性和潜在迟发性不良反应,也能为临床使用规范和后续监管决策提供科学依据。
FDA此前已建议对部分CGT产品实施长期随访研究,强调其对监测迟发性安全事件的重要性。草案进一步明确,批准后需重点关注的疗效指标包括治疗效果的持久性,安全性监测则应覆盖长期生物学效应、未知不良事件以及基础疾病或其治疗相关的死亡事件。

针对儿科患者等特殊群体,草案提出需考虑其整个生命周期的数据追踪需求。由于CGT产品的潜在作用持久,儿科患者可能需从儿童期持续随访至成年,其间涉及护理模式转换、成年后知情同意更新等复杂环节。长期随访期可能长达15年以上,这对研究设计和患者管理提出更高要求。
草案明确两类主要数据获取途径,一类是真实世界数据与真实世界证据,即利用临床实践中产生的数据补充传统临床试验证据;另一类则是电子健康记录、医疗索赔与生命统计数据,即整合多源卫生信息系统数据构建长期随访框架。
FDA同时指出,行政医疗索赔、生命统计和电子健康记录等数据源并非专为产品疗效评估而设计,在罕见病应用中存在明显局限。如患者关键变量信息缺失,诊断延迟和表型异质性常见;医学术语编码不完整或滞后,导致数据结构化程度低、验证困难;数据碎片化问题突出,长期追踪受保险变更和医疗服务衔接影响;小样本背景下统计效能不足,罕见结局分析难度大。
该草案强调,确保数据连续性与完整性是长期结局评估的基础,申办方需审慎评估数据源的适用性,并建立高质量、可持续的数据采集体系。
明确再生医学疗法加速审评路径

《针对严重疾病再生医学疗法的加速审评计划(Expedited Programs for Regenerative Medicine Therapies for Serious Conditions)》指南草案,则为开发用于严重或危及生命疾病的再生医学疗法的申办方提供了加速开发和审评的详细路径。

该指南正式生效后,将取代2019年发布的同名草案版本。
FDA生物制品评价与研究中心(CBER)在草案中指出,再生医学领域发展迅速,在存在未满足医疗需求的严重疾病治疗方面展现出重要潜力。CBER致力于在确保安全有效的前提下,推动此类疗法尽快获批并用于临床。本指南所涉及的加速计划旨在促进针对严重疾病且具有突出临床价值的再生医学疗法的开发和审评。
草案明确,符合加速审评资格的再生医学疗法包括干细胞治疗产品、细胞疗法、治疗性组织工程产品、人源细胞与组织产品及其组合产品。但未经基因修饰的微生物、不表达外源转基因的基因修饰产品(如缺失修饰的腺病毒载体)以及肽治疗性疫苗不属于再生医学疗法范畴。异种移植产品可能符合定义,将根据具体情况进行评估。
新版草案进一步列举了有资格获得加速审评认定的产品类型范例,并细化了开发商在早期研发阶段需确保生产工艺与最终上市产品一致性的要求。
FDA指出,针对小人群的早期临床研究除评估安全性外,也可能提供有效性的初步证据,例如在罕见病研究中观察到的显著疗效信号。若申办方拟利用早期临床研究建立支持上市申请的有效性证据,应在早期开发阶段即对临床样品实施严格的质量控制。
尽管FDA承认生产工艺变更是产品开发中的复杂环节,且此类变更不必然影响RMAT资格的获取或维持,但具体变更和产品可比性评估将采取逐案审查原则,不属于该指南范围。
草案还列举了CBER认为可证明产品有潜力解决未满足医疗需求的初步临床证据示例,如对难治性转移性乳腺癌患者,使用表达肿瘤特异性抗原的同种异体肿瘤细胞系疗法,首次人体研究中大部分受试者达到完全缓解;对治疗难治性不可切除或转移性癌症患者单次施用自体T细胞免疫疗法,导致的客观缓解率高于历史上仅接受化疗的患者。
来源:
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/innovative-designs-clinical-trials-cellular-and-gene-therapy-products-small-populations
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/postapproval-methods-capture-safety-and-efficacy-data-cell-and-gene-therapy-products
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/expedited-programs-regenerative-medicine-therapies-serious-conditions-0




























