在传统药物研发中,化学合成始终是一座难以逾越的技术高山。高度复杂的分子设计、漫长繁复的合成工艺,不仅令新药发现周期延长,更构筑了极高的技术壁垒,将众多创新想法阻挡在实践大门之外。这一“中心化”的研发范式,已成为制约医药创新,特别是提升可及性的核心痛点。然而,一场源自诺贝尔奖的化学范式“革命”,正为破解这一困境带来全新路径。
2022年荣获诺贝尔化学奖的“点击化学”(Click Chemistry),其核心在于利用高效、可靠的模块化反应,快速构建功能分子。在中国,这一“变革”的领军者与深度实践者,是师从“点击化学之父”Karl. Barry Sharpless教授的上海交通大学点击化学实验室主任、迪普深合创始人董佳家教授。为了将点击化学的“去中心化”方法论转化为“颠覆性”的产业工具,他创立了迪普深合医药研发(上海)有限公司(以下简称“迪普深合”),旨在彻底降低药物早期发现的超高门槛,赋能中国创新力量。

上海交通大学点击化学实验室主任、迪普深合创始人董佳家教授
第二代点击化学SuFEx发现人
近日,动脉网对董佳家教授进行了专访,他描绘了一幅更宏大的蓝图:迪普深合有望参与甚至引领一场中国医药产业范式“革命”,且这并非简单的技术升级,而是一场关乎产业逻辑与创新主体等的根本性重塑。
获得诺贝尔奖的点击化学:“范式革命”而非“技术改良”
要理解迪普深合的使命,首先必须理解点击化学的“颠覆性”所在。董佳家教授的阐述,将其从一项看上去十分简单的化学技术,提升到了科学史与产业变革的宏观维度。董佳家教授的职业生涯起步于一家位于中国上海的早期新药研发公司。与当时主流的单一学科外包模式不同,这家公司罕见地尝试将化学与生物学研究紧密结合。这种小而灵活、跨学科无缝协作的“动态”模式,对当时一心向往药物研发的董佳家教授产生了吸引力。在亲历了公司项目——早期开发的钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂——的成功后,董佳家教授获得就职公司创始人、美国生物界顶尖科学家Brian Seed教授的强力推荐,决定重返学术界,申请博士后职位,师从早在学生时代就崇敬的Karl. Barry Sharpless教授。
董佳家教授指出,20世纪上半叶以来的合成化学与制药产业,即“伍德沃德范式”,由美国化学家R. B. Woodward所塑造。这一范式追求合成的艺术性与复杂性,通过高度专业性的合成制造高壁垒来维系价值。它塑造了过去半个世纪以来跨国药企高度中心化的研发模式,依赖于权威专家的精巧设计。然而,全球化浪潮下,这一模式的不可持续性日益凸显。
点击化学正是对“伍德沃德范式”的“战略性”逆转。点击化学是由Karl. Barry Sharpless教授于2001年提出的全新化学合成理念,并于2022年因此再获诺奖:其利用简单高效的化学反应,有效地将化学砌块链接起来,进而实现分子功能。这一过程追求将合成化学技术高度去中心化,使其更有效地转移到相关的交叉学科实践中。
符合点击化学要求的反应具有高产率、作为起始原料的小分子结构简单、几乎不发生不良反应、实验操作简便、能够在水中进行反应等优势。而点击化学的核心理念正是“简单、可靠、高效”。它提供了一套如同“分子乐高”的标准化工具,使得即使非合成化学背景的研究人员(如生物学家)也能快速、模块化地构建大量结构多样的化合物。本质上,这是将药物发现从一门依赖少数精英的“手艺”,转变为一个可大规模、标准化探索的“流程”。董佳家教授形象地比喻:“这好比互联网的出现,使得人人皆可成为信息发布者、传播的参与者,而不再仅仅依赖于传统媒体这一单一渠道。”
另一方面,点击化学的崛起,与人工智能(AI)等大趋势深度契合。AI需要海量的标准化数据(分子)进行学习与预测,而点击化学正是产生这类数据的理想工具。董佳家教授同时指出,中国拥有巨大的未满足医疗需求,而也有丰富的人力(工程师)资源,却缺乏一套高效、可及创新供给的研发体系。点击化学,恰逢其时地提供了方法论上的可能。
超高通量构建技术护城河,去中心化平台助力分子胶突破性发现
迪普深合由此成了点击化学方法论落地的载体。基于对点击化学的洞察,迪普深合构建了其独特的战略架构与核心竞争力。董佳家教授明确区分了迪普深合与传统点击化学公司的本质区别,即需要先回答,迪普深合“不是什么”。
首先是核心定位,即迪普深合要做赋能者,而非制药商等。此外,迪普深合也并非一家传统的定制合成合同研究组织(CRO),其目标是要将药物早期发现,尤其是化合物库构建与筛选的效率提升到极致。换言之,迪普深合的终极愿景是成为一个“去中心化”的药物发现平台。迪普深合希望让高校教授、初创公司等的创新主体,能够以极快的速度验证其药物假设,从而极大地增加创新试错的频次与成功率。
为此,迪普深合致力于在点击化学的应用层面建立技术“护城河”。这不仅体现在庞大的专有砌块库上,更在于其独有的、高效拼接这些“分子乐高”的专利方法学。
董佳家教授和Karl. Barry Sharpless教授团队发现了一种安全高效、从大量可得的一级胺化合物出发直接合成叠氮化合物库的方法,并将其命名为“模块化的点击化合物库方法”。需要指出的是,由叠氮化合物加上炔烃化合物最终合成的三氮唑化合物产品已经可以对应“无穷大”的潜在类药化合物空间。进一步延伸,点击化学精准、快速发现化合物,可能构建世界“唯一”千万级实体分子库。而化合物库是药物筛选基础,国际大型制药企业均拥有大型高质量库。
迪普深合的核心技术使其能够在数周内完成数万乃至数十万个化合物的合成与筛选。董佳家教授透露,迪普深合在与上海交通大学医学院附属瑞金医院卢敏教授合作的分子胶项目中合成了数万个化合物,而这是在极短的周期内实现的,大大提高了研发效率,推动了成果的快速落地。这种“量变”直接引发了“质变”。
此外,值得一提的是,迪普深合与美国斯克里普斯研究所(The Scripps Research Institute,缩写TSRI)等著名机构的合作,发现了50年来“首个”有希望治疗耐药肺结核的新分子,其成果发表于权威期刊Nature[1]。
而据2019年《化学与工程新闻》(C&EN)相关报道:美国生物医学研究所Calibr的药物化学副总裁Mike Petrassi表示,得益于董佳家与Karl. Barry Sharpless所发现的构建三氮唑化合物库的新方法,他们团队从构建的三唑化合物库中,发现了一种对结核病治疗有显著开发潜力的新型候选化合物[2]。不仅如此,迪普深合也与上海科技大学水雯箐课题组合作,通过将模块化点击化合物库与亲和质谱技术联用,设计、合成了一个大规模的、模块化的点击化合物分子库,进而针对胰高血糖素样肽-1受体(GLP-1R)这一挑战性靶点进行筛选,发现了一组新型GLP-1R别构调控小分子化合物,其成果发表于《美国国家科学院院刊》(PNAS)[3]。这些案例充分展示了其技术平台在探索化学空间与发现先导化合物方面所具有的显著优势。
中国创新药新模式启航,完成生态构建的“关键一跃”
董佳家教授坦言,目前迪普深合正积极拓展价值实现路径,探索与各方的生态合作。短期来看,与大型药企、研究机构的战略合作是验证平台能力的有效途径。但从长远发展看,迪普深合旨在构建一个开放的价值网络:以低门槛策略激发广泛的合作潜能,通过与伙伴们共创共享,最终在成功孵化高价值成果时实现共赢。这有赖于其精准识别潜力与设计共赢机制的核心能力。
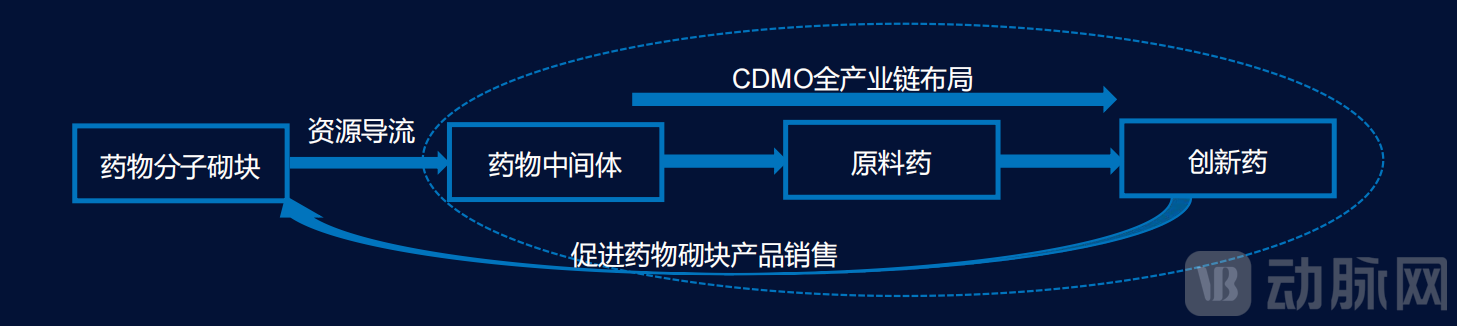
迪普深合手握创新药筛选核心技术与核心原料分子砌块,未来在产业链上可切入药物研发后端市场,
图源自迪普深合
当前,迪普深合计划首先运用已有资源服务高校、医院及科研院所,并建立战略合作伙伴关系;其次,以第一步战略为基础,获得战略合作伙伴及潜在IP(如新靶点候选药物分子),由药物发现阶段,向临床前及临床开发阶段拓展;随后,以AI驱动药物发现进场,提供端到端的药物发现解决方案,进一步拓展可能成药的化合物空间。
与此同时,董佳家教授的思考并未止步于企业自身,而是延伸至整个中国生物医药产业的命运。他将迪普深合的探索置于一个宏大历史背景之下。他表示,中国医药创新必须转向内循环,真正为全中国人的健康需求服务;但前提是,必须建立一套既深度契合中国特征、同时又具备全球竞争力的高效研发体系。
董佳家教授指出,迪普深合并非要独自建成新大厦,而是要充当那个“撬动旧塔基最底层的一块砖”的力量。通过将药物发现的初始门槛降至极低,它有望激发中国的创新活力。此外,真正的创新是“去中心化”模式的。当成千上万的科研工作者能够低门槛地投身于药物发现时,一个“去中心化”的、充满活力的中国医药创新生态才有可能形成。迪普深合要做的,就是站在技术变革的潮头,与时代同行。
写在最后
采访中,董佳家教授多次提到机缘巧合(Serendipity),从首份工作的历练到获得Karl. Barry Sharpless教授的认可,似乎人生关键处总有幸运眷顾。但更深层次看,这更像是一种必然——一位对产业痛点有切肤之痛、又得遇导师指点方向的科学家,在重要转折点上的主动选择。
迪普深合的故事,不仅仅是一家初创企业的发展蓝图,更是一位中国科学家以其全球视野与洞察、对中国医药产业前途的一次充满希望的叩问。它关乎技术,关乎愿景;关乎企业生存,也关乎产业命运。
在点击化学这把“诺奖钥匙”的帮助下,迪普深合正试图开启一扇通往未来的大门,那扇门后,或许是“人人皆可参与创新”的中国医药“新纪元”。这条路注定艰难,但正如董佳家教授所相信的:“一旦尝试点击化学,就再也回不去了。”
未来与变革,或许已然发生。
[1] Krieger, I.V., Sukheja, P., Yang, B. et al. SuFEx-based antitubercular compound irreversibly inhibits Pks13. Nature (2025). doi:10.1038/s41586-025-09286-3
[2] Chemists make arrays of click chemistry–ready azides efficiently and safely. Retrieved October 2, 2019 from https://cen.acs.org/synthesis/Chemists-make-arrays-click-chemistryready/97/i39
[3] Y. Xin, S. Liu, Y. Liu, Z. Qian, H. Liu, B. Zhang, T. Guo, G.J. Thompson, R.C. Stevens, K.B. Sharpless, J. Dong, & W. Shui, Affinity selection of double-click triazole libraries for rapid discovery of allosteric modulators for GLP-1 receptor, Proc. Natl. Acad. Sci. U.S.A. 120 (11) e2220767120, https://doi.org/10.1073/pnas.2220767120 (2023).




























