急性髓系白血病(AML)是一种进展迅速、治疗困难的血液系统恶性肿瘤。据美国癌症协会统计,每年有约22,010名美国人被诊断为AML,其中11,090人将因此失去生命。化疗药物5-氟尿嘧啶(5-Fu)虽然在临床上应用了数十年,但其疗效始终难以令人满意——问题的症结不在于药物本身的化学活性,而在于它"到不了该去的地方"。
这个看似简单的递送难题,实则揭示了现代化疗面临的核心困境:药物难以精准到达癌细胞,却容易误伤健康组织。传统5-Fu存在溶解性差、细胞摄取效率低、非选择性杀伤等问题,使得临床医生不得不在疗效与毒性之间艰难权衡,患者也因此承受着恶心、疲劳甚至心脏毒性等严重副作用的折磨。
针对这一困扰临床数十年的难题,美国西北大学Chad A. Mirkin教授团队另辟蹊径,创新性地将传统5-Fu重构为球形核酸(SNA)纳米结构。这一巧妙设计不仅突破了药物递送瓶颈,更实现了精准靶向与高效杀伤的完美结合。
2025年10月29日,团队在《ACS Nano》发表的研究成果令人振奋:SNA技术使药物杀伤效力提升了10,000-20,000倍,抗肿瘤效果提高59倍,且未观察到明显副作用。这一突破为白血病等难治性肿瘤的治疗带来了革命性的希望。

(来源:ACS Nano)
1困境一:溶解性之殇
5-Fu在许多生物体液中的溶解度不到1%。正如Mirkin教授所言:"很多人知道化疗具有可怕的毒性,但往往忽视了它溶解性差这一根本问题。"药物如果不能溶解在血液中,就会结块或保持固体形态,身体根本无法有效吸收。这就好比把一块石头扔进河里,无论水流多急,石头也到不了下游。
2困境二:非选择性杀伤
传统化疗药物像是"无差别轰炸"——它们杀死癌细胞的同时,也会大量摧毁健康细胞。这导致患者遭受恶心、疲劳等一系列痛苦的副作用,在极端情况下甚至可能引发心力衰竭。而且由于治疗窗口极窄,医生往往不得不在疗效和毒性之间艰难权衡。
3困境三:递送效率低下
即便药物能够溶解并进入血液循环,要真正进入癌细胞内部发挥作用,仍面临重重屏障。传统给药方式下,药物到达率极低,大部分药物在到达目标前就被代谢或排出体外。
Mirkin团队的创新并非简单地改进包装方式,而是从根本上重新设计了药物的分子结构。
球形核酸是Mirkin教授在西北大学发明和发展的一种独特纳米结构,代表了纳米医学的新范式。它由生物相容性磷脂组成的脂质体核心,外层密集排列着DNA或RNA链,形成一个直径约几十纳米的球形结构。这种设计本身就是一个巧妙的"特洛伊木马"策略——看似普通的纳米球体,实则暗藏玄机。
在本次研究中,团队将10个5-氟-2'-脱氧尿苷单元化学连接成寡核苷酸链,并在3'端修饰上六乙二醇和胆固醇基团,使其能够锚定在脂质体表面。关键突破在于:药物不再是被"装"在载体里,而是直接"编织"进DNA链中,成为纳米结构不可分割的一部分。这一结构重构带来的不仅是物理形态的改变,更是功能上的质变。
图:SNA结构示意图(来源:西北大学)
这种结构为何如此有效?答案藏在细胞表面的清道夫受体中。Mirkin教授解释说:"大多数细胞表面都有清道夫受体,但骨髓细胞过度表达这些受体。"这些受体就像细胞的"门卫",专门识别并主动吸收特定结构的分子。SNA恰好拥有这些受体喜欢的"通行证"——密集排列的DNA外壳。更重要的是,AML作为骨髓来源的恶性肿瘤,其细胞表面的清道夫受体密度更高,这就为选择性靶向提供了天然的生物学基础。与传统药物需要"强行闯入"细胞不同,SNA是"受邀进入",效率自然大幅提升。
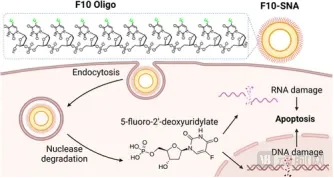
图:SNA发挥作用的过程(来源:ACS Nano)
进入细胞后,SNA的精妙设计开始展现第三重优势。细胞内的酶会识别并分解DNA外壳,逐步释放出药物分子,这个过程就像拆开包裹一样,确保药物在正确的时间、正确的地点发挥作用。由于释放发生在癌细胞内部,药物浓度在局部可以达到极高水平,从而实现强大的杀伤效果。整个过程环环相扣:结构识别→主动摄取→精准释放→高效杀伤,构成了一个完整的"精确制导"系统。
为了验证这个巧妙的理论设计,在体外细胞实验中,研究团队将SNA形式的5-Fu与游离的5-Fu进行了严格的对比测试,结果展现出惊人的效力跃升:细胞摄取效率提高了12.5倍,这意味着相同时间内进入癌细胞的药物量增加了一个数量级;更令人震撼的是细胞杀伤能力的提升——高达10,000-20,000倍(4个数量级),相当于原本需要1万个药物分子才能杀死一个癌细胞,现在只需要1个。这种指数级的效力提升,标志着药物设计思路的根本性突破。
当然,体外实验的成功并不意味着也能在复杂的生命体内重现,从体外实验到活体实验是所有新药研发必须跨越的关键门槛。研究团队在免疫缺陷小鼠的人类AML模型中观察到了更加令人鼓舞的结果:抗肿瘤效力比传统5-Fu高出59倍,血液和脾脏中的白血病细胞被"几乎完全消除",小鼠的生存时间显著延长,而且未检测到明显副作用,健康组织完好无损。这组数据的意义远超数字本身——它证明了在真实的生物体内,SNA不仅保持了体外实验的高效性,还实现了选择性靶向这一传统化疗难以企及的理想状态。
为了全方位验证SNA的性能,研究团队还进行了生物分布和稳定性研究。数据显示,SNA在血清和DNase I环境中表现出良好的稳定性,这意味着药物在体内循环过程中不会过早降解,能够完整地到达目标部位。生物分布研究则进一步证实,药物确实能够富集在目标组织,而非随机分布全身——这正是精准医疗的核心要义。
从结构设计到功能验证,从体外到体内,从效力到安全性,每一个环节都指向同一个结论:SNA技术实现了化疗药物从"地毯式轰炸"到"精确制导"的革命性转变。
这项研究的意义远超白血病治疗本身,它代表了一个新兴领域——结构纳米医学的成功范例。与传统纳米医学仅关注材料成分不同,结构纳米医学强调通过精确控制纳米结构的几何形状、表面化学和物理特性,来微调其与生物系统的相互作用。
正如Mirkin教授所指出的:"纳米医学的结构可以深刻影响化疗药物的递送和细胞靶向。"SNA的球形对称性、DNA外壳的密度和排列方式、药物分子的空间分布——每一个结构参数都经过精心设计,共同决定了其卓越性能。这标志着药物开发理念的深刻转变:结构即功能,设计决定疗效。
这种理念转变带来的最直观体现,是化疗模式从"地毯式轰炸"到"精确制导"的根本性变革。传统化疗的哲学是"宁可错杀一千"——用高剂量药物覆盖全身,希望能够杀死足够多的癌细胞。而SNA技术则实现了范式转变,如Mirkin教授所言:"今天的化疗药物杀死它们遇到的一切,我们的结构纳米医学优先寻找骨髓细胞,在确切需要的位置提供更高、更集中的剂量。"
而且,SNA技术的通用性为其广泛应用奠定了基础。目前已有7种基于SNA的疗法进入临床试验阶段,涵盖的领域远超白血病治疗,包括癌症、传染病、神经退行性疾病和自身免疫性疾病。
其通用性在于其可编程的设计逻辑:通过改变DNA序列、修饰基团和携带的药物分子,可以定制出针对不同疾病、不同靶细胞的治疗方案。这就像是一个开放的纳米平台,具有无限的拓展可能。
而从SNA这一成功案例中,我们也能够清晰地洞察纳米医学发展的未来走向。首先是从被动递送到主动靶向的转变。传统药物递送依赖被动扩散和随机分布,而SNA通过受体介导的主动摄取,实现了"主动找到靶点"。未来的纳米药物将更多地利用生物识别机制,设计出能够自主寻找病变组织的"智能药物"。
其次是从单一功能到多功能集成的演进。SNA同时具备药物载体、靶向配体和保护外壳的功能,实现了结构与功能的完美统一。未来纳米医学将朝着多功能集成方向发展,在一个纳米平台上整合诊断、治疗和监测功能,实现真正的"诊疗一体化"。这种集成不是简单的功能叠加,而是协同增效的系统设计。
第三个趋势是从经验设计到理性设计的跨越。SNA的成功基于对细胞生物学和纳米材料学的深刻理解,代表了从"试错"到"理性设计"的转变。随着对纳米-生物界面作用机制认识的深入,结合计算模拟和人工智能技术,未来将能够更加精准地预测和设计纳米药物的性能,大幅缩短研发周期,降低失败率。
最后是从实验室到临床的加速转化。随着监管路径的逐步明确、生产工艺的成熟以及临床数据的积累,纳米医学从基础研究到临床应用的周期有望大幅缩短。这不仅是技术的进步,更是制度、产业和临床实践的协同演化。
回到这项研究本身,Mirkin教授团队也正计划将研究推进到更大规模的动物实验,最终进入人类临床试验。"如果这能够转化到人类患者身上,将意味着更有效的化疗、更好的反应率和更少的副作用,"他说,"这始终是任何癌症治疗的目标。"
在精准医疗的时代,球形核酸技术代表了一个激动人心的方向——让药物不仅知道"打什么",更知道"怎么打"。这或许就是纳米医学为人类健康带来的最大价值。




























