想象一下,只需一次静脉注射,就能永久告别每天服用降脂药的日子。随着CRISPR基因编辑技术的最新突破,这个愿景正在逐步成为现实。
11月8日,《新英格兰医学杂志(NEJM)》发表了一项令人瞩目的临床试验结果:研究人员利用CRISPR-Cas9基因编辑技术,成功将15名难治性高血脂患者的胆固醇水平降低了约50%。这是基因编辑技术首次在心血管疾病这一常见病领域展现出巨大潜力,标志着这项曾经只用于罕见遗传病的"未来技术",正在真正走向大众。

(来源:NEJM)
心血管疾病是全球头号杀手,而高胆固醇是其主要危险因素之一。目前,数以亿计的患者依赖他汀类药物等降脂治疗,但这些药物需要终生每日服用。更严峻的是,在治疗开始后的12个月内,多达一半的患者会因为各种原因停止用药,使得治疗效果大打折扣。如果基因编辑能够实现一次治疗、终生受益,将彻底改变心血管疾病的防治格局。
"能够做到这一点将是一场革命,"俄亥俄州克利夫兰诊所的预防心脏病学专家、该试验的首席研究员卢克·拉芬(Luke Laffin)说道。"从概念上讲,这是一个绝妙的想法:我们可以将慢性疗法转向一次性治疗。"
这项研究的成功,源于科学家们从自然界中获得的启示。
研究人员发现,一些人天生携带ANGPTL3基因的功能缺失突变。ANGPTL3是一种主要由肝脏产生的蛋白质,它通过抑制脂蛋白脂肪酶和内皮脂肪酶,调控血液中脂肪分子的水平。而那些ANGPTL3基因功能缺失的人,终生保持着较低的胆固醇和甘油三酯水平,心血管疾病风险显著降低,却没有出现任何明显的健康问题。
这一自然实验为科学家们指明了方向:如果能人为地"关闭"ANGPTL3基因,是否也能达到同样的降脂效果?ANGPTL3成为理想的基因编辑靶点,不仅因为它几乎只在肝脏表达,便于精准治疗,更因为它同时影响低密度脂蛋白(LDL,即"坏"胆固醇)和甘油三酯这两种致动脉粥样硬化的脂蛋白——而目前还没有任何一种药物能同时显著降低这两者。
要在人体内精准编辑基因,需要解决两个关键问题:如何找到目标基因,以及如何把"基因剪刀"送到正确的位置。
研究团队开发的CTX310,正是这样一套精巧的系统。它的核心是CRISPR-Cas9技术,Cas9蛋白就像一把分子剪刀,在引导RNA的指引下,能精准定位并切断ANGPTL3基因的特定位置,使其失去功能。为了把这套"工具"送到肝细胞中,研究人员将编码Cas9的信使RNA和引导RNA一起包裹在脂质纳米颗粒中。这些纳米颗粒就像一个个微型"快递包裹",通过静脉注射进入血液后,能够被肝细胞特异性识别并摄取,然后释放出CRISPR组件,在细胞核内完成基因编辑。
与其他疗法相比,基因编辑的最大优势在于一劳永逸。例如,同样靶向ANGPTL3的单克隆抗体药物evinacumab,虽然已被批准用于治疗家族性高胆固醇血症,但需要定期输注。而基因编辑一旦完成,被编辑的肝细胞会持续存在,理论上可以产生永久性的降脂效果。
这项1期临床试验在澳大利亚、新西兰和英国的六个研究中心进行,招募的都是那些对最大耐受剂量的降脂治疗仍然难以控制的患者。15名受试者的中位年龄为53岁,40%患有动脉粥样硬化性心血管疾病,40%被诊断为家族性高胆固醇血症。
试验采用了剂量递增的设计,从每千克体重0.1毫克逐步提升至0.8毫克。结果令人振奋:
显著的降脂效果:接受最高剂量(0.8毫克/千克)治疗的4名患者,在60天后LDL胆固醇水平平均降低了48.9%,甘油三酯水平平均降低了55.2%。
靶蛋白大幅下降:高剂量组的ANGPTL3蛋白水平降幅达到73-80%,表明基因编辑在肝细胞中得到了广泛实施。
效果持续时间:所有受试者都完成了至少60天的随访,降脂效果依然持续,且更长期的随访仍在进行中。
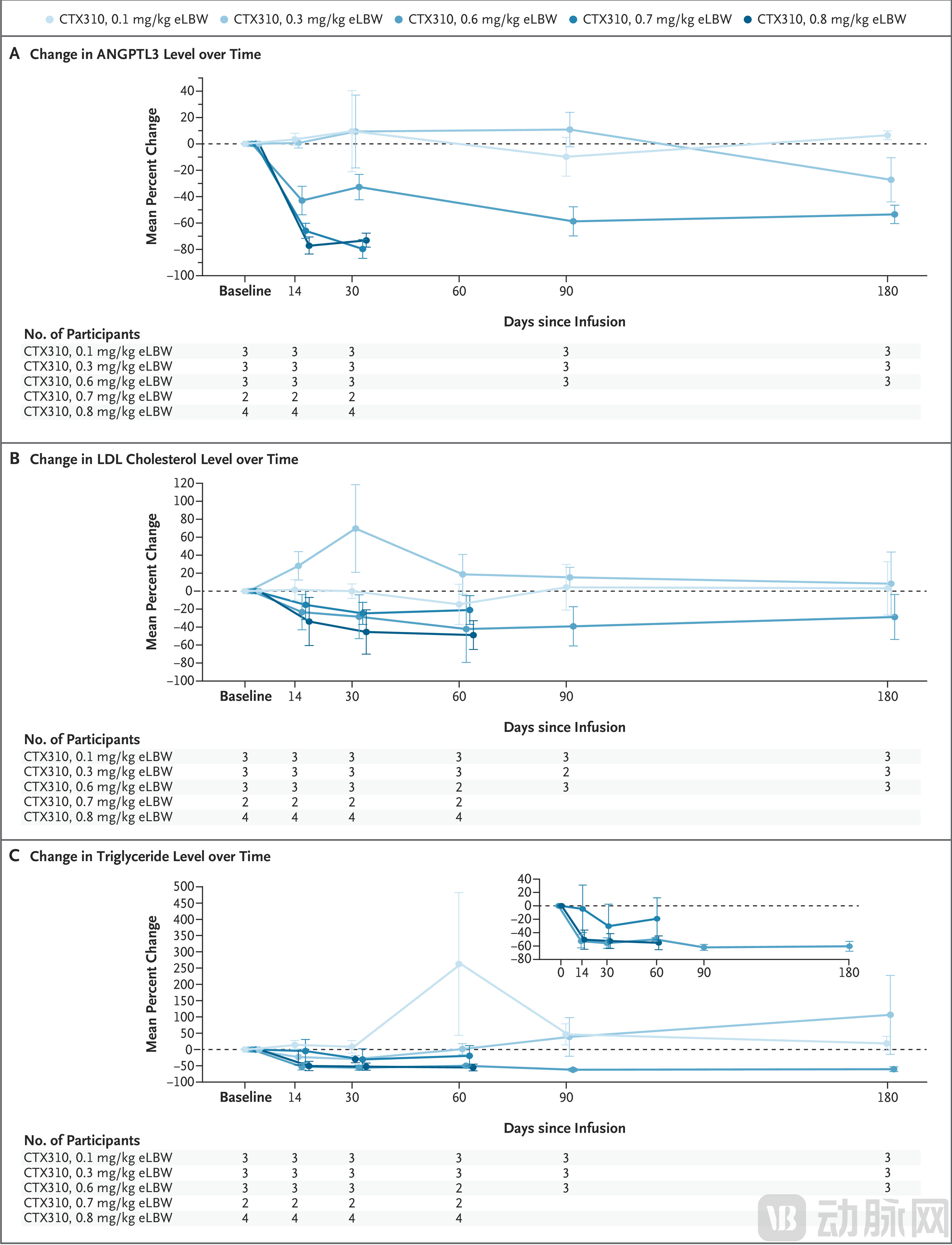
图:CTX310 治疗后 ANGPTL3、LDL 胆固醇和甘油三酯水平随时间的变化(来源:NEJM)
从安全性角度看,试验结果总体可控。3名受试者(20%)出现了输液相关反应,表现为背痛和恶心,但通过暂停输液和对症处理,所有人都顺利完成了治疗。1名基线转氨酶水平就偏高的患者,在接受最高剂量治疗后出现了转氨酶短暂升高(达到基线的3-5倍),但在14天内自行恢复正常,没有其他肝功能异常的迹象。
需要特别说明的是,试验中有1名接受最低剂量(0.1毫克/千克)治疗的患者,在第179天突然死亡。由于随访时间较长且剂量较低,研究人员尚无法确定这一死亡事件是否与治疗有关,这也提醒我们,对于基因编辑这种不可逆的治疗手段,长期安全性监测至关重要
时间倒回十多年前,费城宾夕法尼亚大学佩雷尔曼医学院的心脏病专家基兰·穆苏努鲁(Kiran Musunuru)萌生了一个大胆的想法:能否用刚刚诞生的CRISPR-Cas9技术,来预防或治疗世界头号杀手——心血管疾病?
他满怀热情地向几位风险投资家推销这个构想,但得到的回应却让人沮丧。"根本没有人感兴趣,"穆苏努鲁回忆道。彼时的投资者们只关注罕见遗传疾病,认为常见病的市场虽大,但技术难度和监管风险都太高。
十年河东,十年河西。如今,穆苏努鲁表示,他知道有大约十几家公司正在使用基因编辑技术应对高胆固醇问题。位于瑞士楚格的生物技术公司CRISPR Therapeutics,也是本次胆固醇试验的赞助方,甚至已经开始研发用于治疗高血压的基因编辑疗法。其他心血管项目还包括治疗转甲状腺素蛋白淀粉样变性等较罕见的疾病。
"这是一片肥沃的土壤,"穆苏努鲁说,他本人也是一家追求类似治疗的公司的联合创始人。
这种转变,标志着CRISPR技术正在从罕见病走向常见病,从实验室走向临床,从小众市场迈向大众健康。技术的成熟、监管路径的逐渐清晰,以及早期罕见病治疗的成功经验,都为这一转变铺平了道路。
尽管前景诱人,但从15人的小型试验到真正惠及千百万患者,还有一条漫长而谨慎的道路要走。
首先,脱靶效应是悬在基因编辑头上的达摩克利斯之剑。
"随着治疗人数的增加,你可能遇到携带某种变异体的患者的累积概率会更大,而这种变异体可能导致新的脱靶活性,"田纳西州孟菲斯圣裘德儿童研究医院研究基因编辑的盛达·蔡(Shengdar Tsai)说。好消息是,科学家们预测一个人的基因组序列如何影响脱靶变化的能力正在提高。
"我们现在还没有达到那个境界,"威斯康星大学麦迪逊分校的生物医学工程师克里沙努·萨哈(Krishanu Saha)表示,"但看起来我们正在朝着那个方向前进。"
长期安全性是另一个关键问题。基因编辑的不可逆性是把双刃剑,它带来持久疗效的同时,也意味着一旦出现问题无法"撤销"。美国FDA目前的指南建议,对接受体内基因编辑治疗的患者进行长达15年的随访。
此外,试验本身也存在明显局限:样本量仅15人,入组人群的种族和民族多样性有限,女性参与者很少,这些都限制了结果的推广性。研究人员也坦承,不同患者对相同剂量的反应存在较大差异,可能与肝脏脂肪变性、炎症状态以及个体遗传和代谢特征有关,这些都需要进一步研究。
还有一个无法回避的现实问题,那就是成本。基因编辑疗法的研发和生产成本极高,最终定价可能让大多数患者望而却步。如何在创新激励与可及性之间找到平衡,是整个行业需要面对的挑战。
面对这些挑战,研究人员和监管机构都选择了谨慎推进的策略。
CRISPR Therapeutics的下一步计划是扩大临床试验规模,但招募对象仍将严格限定在那些胆固醇或甘油三酯水平极高、且无法通过他汀类药物等现有治疗充分控制的患者。
这些患者面临着极高的心血管事件风险,对他们而言,基因编辑可能带来的收益明显大于风险。尤其是对于家族性高胆固醇血症的患者来说,一次性的基因编辑治疗更具吸引力。
至于将基因编辑疗法扩展到更广泛的人群,穆苏努鲁表示"可能需要十多年的时间"。
但拉芬对这个远期愿景充满乐观:"这个想法是能够对三十多岁甚至二十多岁的人说:'你有很强的家族史:家里每个人都在四十多岁时心脏病发作。我们能不能就给你这种治疗,然后就不用再担心了。'"
从罕见病到常见重症患者,再到高危年轻人群,这是一条需要数十年才能走完的路。每一步都需要大规模的安全性研究、严格的监管审批,以及技术的持续优化。
从某种意义上说,这项临床试验的价值,不仅在于它展示的降脂效果,更在于它所代表的范式转变。
从2012年CRISPR-Cas9技术诞生,到2023年首个CRISPR疗法获批用于治疗镰状细胞病和β地中海贫血,再到如今开始探索在心血管疾病这一影响数亿人的领域应用,基因编辑在短短十几年间完成了从概念验证到临床转化的跨越。
虽然CTX310目前只是走完了万里长征的第一步,从15人的初步试验到真正惠及千百万患者,需要更多的数据、更长的时间、更严格的验证,但这项研究已经让我们看到了一种可能性。




























