2025年11月19日,浙江大学牵头的研究团队在国际顶级学术期刊《自然》(Nature)发表突破性研究成果,首次报道了一种皮肤渗透性高分子聚合物OP,成功实现了胰岛素的无创透皮给药。
这项研究由浙江大学化学工程与生物工程学院申有青教授、生命科学学院周如鸿教授、英国帝国理工学院陈荣军教授及浙江大学化工学院相佳佳研究员共同领衔,韦秋雨、何至、李梓凡、周珠贤为共同第一作者。

(来源:Nature)
这项成果的意义在于打破了困扰医药学界数十年的"500道尔顿规则"——长期以来,学界普遍认为分子量超过500道尔顿的大分子药物无法通过无创方式穿透完整的皮肤屏障。而胰岛素作为一种蛋白质类大分子,其分子量远超这一安全线数倍。研究团队通过巧妙的分子设计,让OP聚合物能够利用皮肤自身的pH梯度,在酸性环境下带正电富集于角质层,在中性环境下转变为聚两性离子快速扩散,并通过"跳跃式移动"避开酶降解,最终将胰岛素递送入血液循环。
在糖尿病小鼠和小型猪模型中,透皮给药的OP-胰岛素偶联物表现出与皮下注射相当的降糖效果,其中小鼠模型中仅需1小时即可使血糖降至正常范围,药效持续超过12小时,且未对皮肤造成任何损伤。
这项突破不仅为全球5亿多糖尿病患者带来了"告别针头"的希望,更开辟了生物大分子透皮递送的全新技术路径。研究团队已成功将该技术扩展至GLP-1类药物(司美格鲁肽、利拉鲁肽)、治疗性蛋白质、单克隆抗体以及siRNA等多种大分子药物的递送。据报道,相关技术已转让企业并推进临床转化。
英国巴斯大学药物科学家Richard Guy评价这项工作"非常令人兴奋"且"优雅",因为它与皮肤的自然特性协同工作,而不是试图强制药物通过。这正是基础研究推动技术创新、最终造福人类健康的生动案例。
对于全球超过5亿的糖尿病患者而言,每天1-4次的胰岛素注射已经成为生活中不可或缺却又痛苦的一部分。针头带来的疼痛、反复注射导致的皮肤并发症、挥之不去的针头恐惧症,以及随时可能出现的低血糖风险——这些问题长期困扰着糖尿病临床治疗与患者生活质量。
能否找到一种无痛、便捷的胰岛素给药方式?这个看似简单的问题,却是医药学界数十年来未能攻克的难题。
透皮给药在医药领域有着悠久的历史。从古代的膏药外敷,到现代的部分麻醉药、心血管药物贴片,透皮给药以其便捷、无痛的优势被广泛应用。然而,能够成功穿透皮肤的几乎都是分子量小于500道尔顿(Da)的小分子药物,这就是透皮给药领域的"500道尔顿规则"。而胰岛素作为一种蛋白质类大分子,不仅分子量远超这一安全线,结构也极其复杂。长期以来,学界普遍认为这类生物大分子不可能通过无创方式穿透完整的皮肤屏障。
要理解这个难题的根源,需要了解人体皮肤这个精妙的防御系统。最外层的角质层虽然厚度仅有10-15微米,但其结构却异常致密:脱水的死角质细胞嵌入高度有序的脂质层中,形成了一个既疏水又难以穿透的屏障。这就像一堵由砖块(角质细胞)和水泥(脂质)构成的坚固"城墙"。紧邻角质层下方的活性表皮层和真皮层,细胞间存在着紧密连接,进一步加固了这道防线。这个多层防御系统能有效阻止外界物质的入侵,保护人体免受病原体和有害物质的侵害,但同时也成为了药物递送的巨大障碍。
为了突破这道屏障,研究者们尝试了多种方法。化学促渗剂通过使角质层脂质双层流动化来增强渗透,但效果有限且可能损伤皮肤;微针技术虽然比注射创伤小,但仍需刺穿角质层进入真皮组织;电学设备、超声和喷射注射则试图在皮肤表面创建瞬时通道。
这些侵入性技术都存在一个共同问题:它们或多或少会破坏皮肤的完整性,带来不便、感染风险和安全担忧。正如英国巴斯大学药物科学家Richard Guy所评价的:"传统方法都在试图强制药物通过皮肤,而不是与皮肤的自然特性协同工作。"
重大科学发现往往始于一个看似简单的问题。
浙江大学申有青教授团队长期专注于高分子药物递送研究,在前期研究中,他们发现了一种两性离子聚合物OP——聚[2-(N-氧化物-N,N-二甲基氨基)乙基甲基丙烯酸酯],它在肿瘤组织中表现出出众的渗透性,能够高效递送抗肿瘤药物。

图:研究团队(来源:浙江大学)
"由此,我们猜测,OP是否也能高效地渗透皮肤组织呢?"这个灵光一现的想法,让申有青敏锐地捕捉到了潜在的研究方向。随后的实验结果让整个团队倍感惊喜:OP在皮肤上同样表现出了高渗透性。"这打破了我们对'大分子无法透过皮肤屏障'的常规认知,"申有青表示。团队随即联合周如鸿、陈荣军团队,展开系统研究,深入分析OP透过皮肤的具体路径和机制。
OP聚合物之所以能成功穿透皮肤屏障,关键在于它巧妙利用了皮肤自身的生理特性——pH梯度。

图:OP-I在角质层扩散的分子动力学模拟(来源:浙江大学)
在自然进化过程中,人体皮肤形成了一个独特的pH梯度:从表面(皮脂膜及角质层表层)的弱酸性微环境(pH≈5)到内部的中性环境(pH≈7)。OP聚合物的设计正是精准适配了这一生理特征。它含有三级胺氧化物基团,这个化学结构赋予了它独特的pH响应性:在酸性环境下发生质子化,带上正电荷成为聚阳离子;而在中性环境下则去质子化,转变为电中性的聚两性离子。
这种pH响应特性让OP成为了一个可以灵活变形的"快递员"。
当OP应用到皮肤表面时,在皮脂层和角质层表层的弱酸性条件下,它带上正电"伪装"成脂质的好朋友,通过静电相互作用与角质层细胞间隙中带负电的脂肪酸紧密结合,在皮肤表面形成局部高浓度的"药物储库",为后续渗透提供浓度梯度。随着渗透深度增加,当OP进入角质层内侧至活性表皮层时,周围环境的pH升至中性,它发生去质子化转变为电中性且非常亲水的聚两性离子。此时,OP失去了与角质层脂质的静电相互作用,得以快速扩散通过角质细胞间隙,实现高效渗透。
周如鸿教授团队通过分子动力学模拟与结合自由能计算,从原子层面阐明了这一"适配皮肤生理pH梯度的智能递药机制"。
更令人惊叹的是,OP还有另一个绝技。当与胰岛素化学偶联形成OP-I后,这个复合物进入活性表皮层和真皮层时,会沿着细胞膜表面发生"跳跃式移动"。研究团队通过全内反射荧光显微镜直接观察到了这一现象。
这种"跳跃递送"策略极其巧妙:通过在细胞膜表面移动而不进入细胞内部,OP-I有效避开了细胞内酶的降解。最终,它经真皮层的淋巴管进入体循环,实现胰岛素的全身递送。这就像是让OP这个可以灵活变形的"快递员",带着胰岛素"包裹"钻过皮肤"城墙"递送至血液中。
为了深入理解这一机制,研究团队运用了多种先进技术进行验证。研究团队使用5纳米金纳米颗粒标记OP,通过高角度环形暗场成像-扫描透射电子显微镜直接观察到了OP在角质层中的渗透路径。使用共聚焦激光扫描显微镜,研究人员还直接观察到OP-I在人角质形成细胞之间的转移过程,证实了细胞接触介导的转移机制。这些严谨的实验和模拟,从多个层面验证了OP的透皮机制,为这项技术提供了坚实的科学基础。
为了验证实用效果,研究团队在两种糖尿病动物模型中进行了系统的药效评估。在链脲佐菌素诱导的1型糖尿病小鼠模型中,研究团队给予116 U/kg剂量的OP-I进行背部皮肤局部应用。结果显示仅需1小时,血糖即可快速降至正常范围,降糖效果与皮下注射胰岛素相当,药效持续超过12小时,且无低血糖风险。
小型猪的皮肤结构与人类更为相似,是评估透皮给药技术能否应用于人体的重要模型。在糖尿病小型猪实验中,研究团队在100平方厘米的皮肤面积上应用29 U/kg剂量的OP-I,成功使血糖水平正常化,且OP-I成功渗透所有皮肤层,未对皮肤造成任何损伤。值得注意的是,小型猪所需的剂量远低于小鼠,这可能与不同物种的皮肤结构和代谢特点有关,这一结果也为未来人体临床试验的剂量设计提供了重要参考。
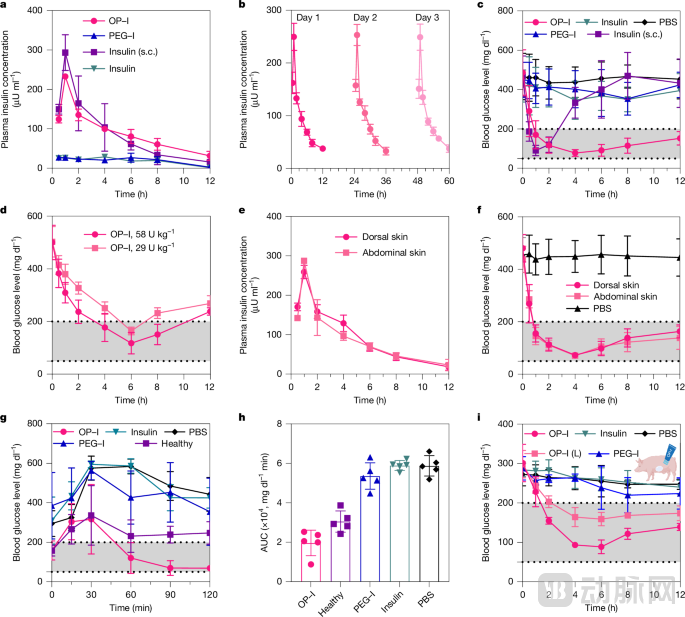
图:OP-I经皮给药的降糖效果(来源:Nature)
研究团队还进行了全面的安全性评估。皮肤组织学检查显示,持续给药后,动物皮肤角质层结构完整,细胞间隙无扩张现象,未观察到炎症反应。系统毒性评估表明,血液学检查、生化指标以及肝肾功能指标均正常,组织病理学检查未见异常。这些数据表明,与传统的化学促渗剂不同,OP-I并不通过破坏皮肤屏障来实现渗透,而是利用皮肤的生理特性"智能通过",因此具有更高的安全性。
一个关键问题是,与OP偶联后,胰岛素是否仍然保持其生物学活性?
研究团队通过表面等离子体共振实验证实,OP-I与胰岛素受体的结合能力与天然胰岛素相当。分子动力学模拟也展示了OP-I与胰岛素受体的完整结合过程。此外,组织分布研究显示,OP-I能够高效靶向肝脏、脂肪、肌肉等血糖调控的关键组织,为其强效降糖效应提供了明确的机制支撑。
从分子设计到机制阐明,再到动物实验验证,这项研究构建了一个完整而严谨的科学证据链。
这项研究的意义远超胰岛素递送本身,它在多个层面上也都具有重要价值。
从科学角度来看,这是对传统认知的重大突破。研究首次证明分子量达4.5 kDa的聚合物可以通过无创方式穿透完整皮肤,挑战了"500道尔顿规则"这一长期存在的理论限制。更重要的是,它提出了pH响应性聚合物利用皮肤生理梯度进行渗透的新机制,从聚阳离子到聚两性离子的动态转变策略,以及"跳跃式递送"避免酶降解的巧妙设计,为未来大分子透皮递送提供了全新的设计思路。
正如ScienceNews在报道中所指出的,Richard Guy教授评价这项工作"非常令人兴奋",因为它的方法"优雅"——与皮肤的自然特性协同工作,而不是试图强制药物通过。
对于全球5亿多糖尿病患者而言,这项技术可能带来革命性的改变。Inside Precision Medicine的报道引用了研究团队的话:"OP代表了一种有前景的非侵入性透皮胰岛素递送系统,为糖尿病管理提供了皮下注射的理想替代方案。"
而且正如研究论文所述:OP偶联对于肽类、蛋白质和核酸等生物大分子的透皮递送具有通用性,拥有广泛的治疗应用前景。目前,研究团队已成功将该技术扩展至利拉鲁肽、司美格鲁肽(Ozempic的活性成分)等GLP-1类药物、治疗性蛋白质、单克隆抗体以及siRNA。这种普适性意味着OP不仅仅是一个针对胰岛素的特定解决方案,而是一个通用的生物大分子透皮递送平台。潜在应用还包括生长激素、疫苗,以及类风湿关节炎等需要长期注射的慢性疾病治疗。
据报道,相关技术已转让企业并推进临床转化,研究团队正在与公司合作开发该技术用于临床应用。如果成功通过临床试验,将重构生物大分子给药体系,带来巨大的经济和社会价值。
从古代的膏药外敷到现代的透皮贴片,人类一直在探索通过皮肤给药的可能性。浙江大学团队的这项研究,通过巧妙的分子设计,利用皮肤自身的生理特性,实现了看似不可能的突破。对于全球数亿糖尿病患者而言,"告别针头"也不再是奢望。从实验室的一个"灵光一现",到Nature的重磅论文,再到未来可能的临床应用——这正是基础研究推动技术创新、最终造福人类的生动案例。




























