全球有超过8000种遗传疾病共同影响着数亿患者,而现有的基因编辑疗法面临一个根本性挑战:每种疾病、甚至每个突变都需要开发不同的治疗方案。
尽管迄今为止已有70多项基因编辑临床试验在镰状细胞病、高胆固醇血症等疾病中显示出疗效,但在超过20万个已知致病突变中,为每一个突变开发独立的治疗方案在监管、开发和制造成本上仍然不切实际。
2025年11月19日发表在《Nature》期刊上的一项突破性研究为这一困境带来了新的曙光。来自Broad研究所和哈佛大学的David Liu团队开发了一种名为PERT(Prime editing-mediated readthrough of premature termination codons)的创新策略,首次实现了疾病无关性基因编辑——单一工具可以治疗多种由相同类型突变引起的遗传疾病。

(来源:Nature)
正如Liu在接受Nature采访时所说:“像这样的疾病无关性方法为患者带来了令人难以置信的激动人心的可能性。”这项研究不仅在技术上取得了重大突破,更重要的是,它可能从根本上改变遗传疾病的治疗模式。
在人类基因组中,DNA序列通过密码子的形式编码蛋白质信息。然而,当基因发生突变,将原本编码氨基酸的密码子变成终止密码子(TAG、TAA或TGA)时,就会导致无义突变,即细胞的蛋白质合成机器会提前终止翻译,产生截短的、通常无功能的蛋白质。
根据ClinVar数据库的统计,无义突变占已知致病性等位基因的24%,是导致遗传疾病的主要原因之一。这些无义突变虽然分布在不同的基因中、导致不同的疾病,但它们都有一个共同的分子后果:在功能性蛋白质能够完整产生之前就终止了翻译。这一共性为开发通用治疗方法提供了理论基础。
抑制性tRNA(suppressor tRNA,简称sup-tRNA)是一类特殊的转运RNA分子,其反密码子能够识别终止密码子,并在该位置插入一个氨基酸,从而允许蛋白质合成继续进行,通读本应终止的位置。这种机制为治疗无义突变提供了一个优雅的解决方案。
然而,人们对sup-tRNA的一个合理担忧是:它会不会也通读那些正常的、基因末端的终止密码子,从而产生异常延长的蛋白质?
多项研究表明这种风险实际上很低,原因包括:提前终止密码子与天然终止密码子的分布模式不同;天然终止密码子后常有多个冗余的终止密码子;以及细胞中存在多种机制优先识别天然终止密码子。因此,在真核生物中,天然存在和外源性的sup-tRNA都可以表达而没有明显的毒性。
尽管sup-tRNA的治疗潜力早已被认识,但将其应用于临床仍面临重大挑战。无论是病毒载体递送,还是脂质纳米颗粒递送,都面临着引发免疫反应的危险以及需要重复给药的负担。即使成功递送,现有方法也往往需要高水平过表达sup-tRNA才能达到治疗效果,而tRNA过表达可能改变全局翻译并增加毒性风险。
正是在这样的背景下,David Liu团队提出了一个大胆的设想:能否利用基因编辑技术,将sup-tRNA永久安装到基因组中,让它以内源性水平表达,既避免重复给药,又降低过表达的风险?
几年前,在David Liu实验室年度retreat的“科学卡拉OK活动”中,David Liu提出了将抑制性tRNA与Prime编辑技术结合的设想。
“科学卡拉OK”虽然名为“卡拉OK”,但并不需要唱歌,而是一个鼓励团队成员提出天马行空项目想法的传统活动,每个成员用10分钟展示一个可能让实验室走向新方向的突破性想法。演讲结束时,David Liu问实验室成员是否有人愿意接手这个项目,几位成员自愿加入,PERT项目由此启动。
PERT策略的核心是Prime编辑技术,这是Liu团队此前开发的一种精确基因编辑工具。与传统的CRISPR系统不同,Prime编辑器结合了可编程的切口酶和逆转录酶,能够像文字处理器一样,搜索、剪切并用新序列替换目标DNA片段,而不会造成双链断裂,因此更加安全和精确。
PERT策略的巧妙之处在于,利用Prime编辑器将人体基因组中418个内源性tRNA中的某一个,通过几个碱基的改变,永久性地转换为优化的抑制性tRNA。这样,改造后的tRNA基因会在原有的调控机制下正常表达,无需外源载体的持续存在,也不会产生过表达。
要实现这一设想,还需要回答一个关键问题:在418个人类tRNA中,哪一个最适合被改造成高效的抑制性tRNA?
David Liu团队开展了一项规模空前的系统筛选工作,评估了全部418个高置信度人类tRNA的数万个变体。他们针对三种终止密码子(TAG、TGA和TAA)分别进行了迭代筛选,包括初始慢病毒sup-tRNA筛选、前导序列和终止序列优化、单个sup-tRNA的饱和突变筛选以及特定tRNA家族(如Leu-TAA家族)的饱和突变筛选。
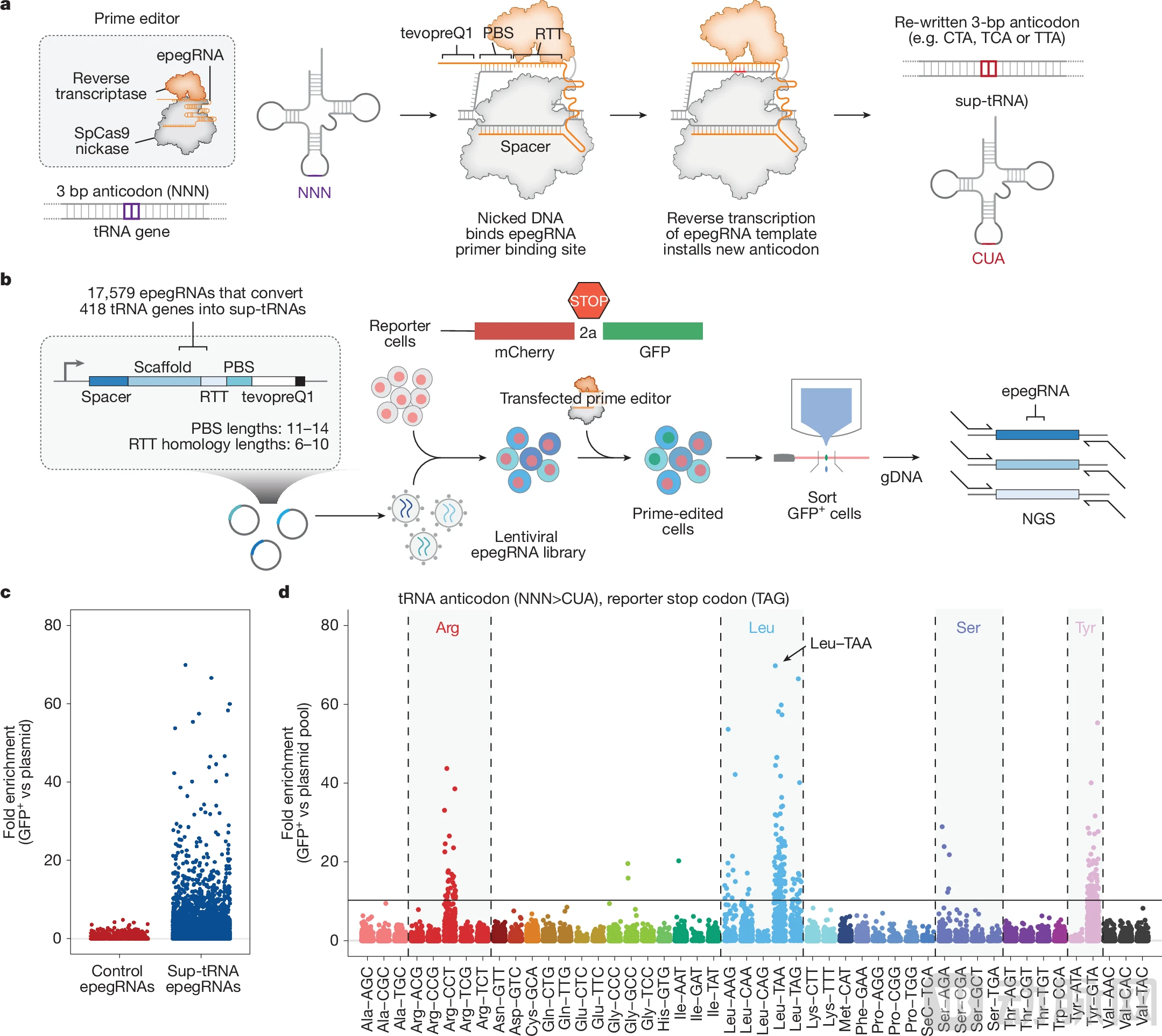
图:哺乳动物细胞中内源性 tRNA 通过 Prime 编辑介导转化为 sup-tRNA(来源:Nature)
通过这一系列筛选,研究团队最终确定了具有最强抑制性tRNA潜力的候选基因,并通过工程化优化显著提高了它们的通读效率。关键的是,这些优化后的sup-tRNA在内源性表达水平下就能发挥治疗作用,无需过表达。
为了高效地将选定的tRNA转换为sup-tRNA,研究团队还对Prime编辑工具进行了优化,开发了工程化的pegRNA(epegRNA)。这些优化确保了在单个基因组位点能够精确安装工程化的sup-tRNA,同时保持内源性表达调控不变。
研究团队首先在实验室培养的人类细胞中进行了验证,这些细胞携带了导致四种严重遗传疾病的无义突变,包括囊性纤维化(一种影响肺和消化系统的遗传病)、Batten病(一种致命的神经退行性疾病)、Tay-Sachs病(一种导致神经系统进行性损伤的疾病)和Niemann-Pick病(一种脂质代谢障碍疾病)。
在所有这些细胞模型中,PERT都能够成功恢复一定程度的正常蛋白质活性,证明了该方法的广泛适用性。
更重要的验证来自体内实验。研究团队在小鼠模型中测试了PERT,这些小鼠携带IDUA基因的无义突变,导致类似于人类Hurler综合征的严重疾病——细胞中会积累有毒废物。
结果显示PERT仅将完整IDUA蛋白的产量恢复到正常水平的最高7.6%,这一看似很低的恢复水平就足以显著缓解小鼠的症状。具体表现包括显著改善了组织病理学表现、减少了糖胺聚糖(GAG)的病理性储存、改善了脑组织和肝脏的病理状态,而且治疗组小鼠体重正常,无明显毒性迹象。
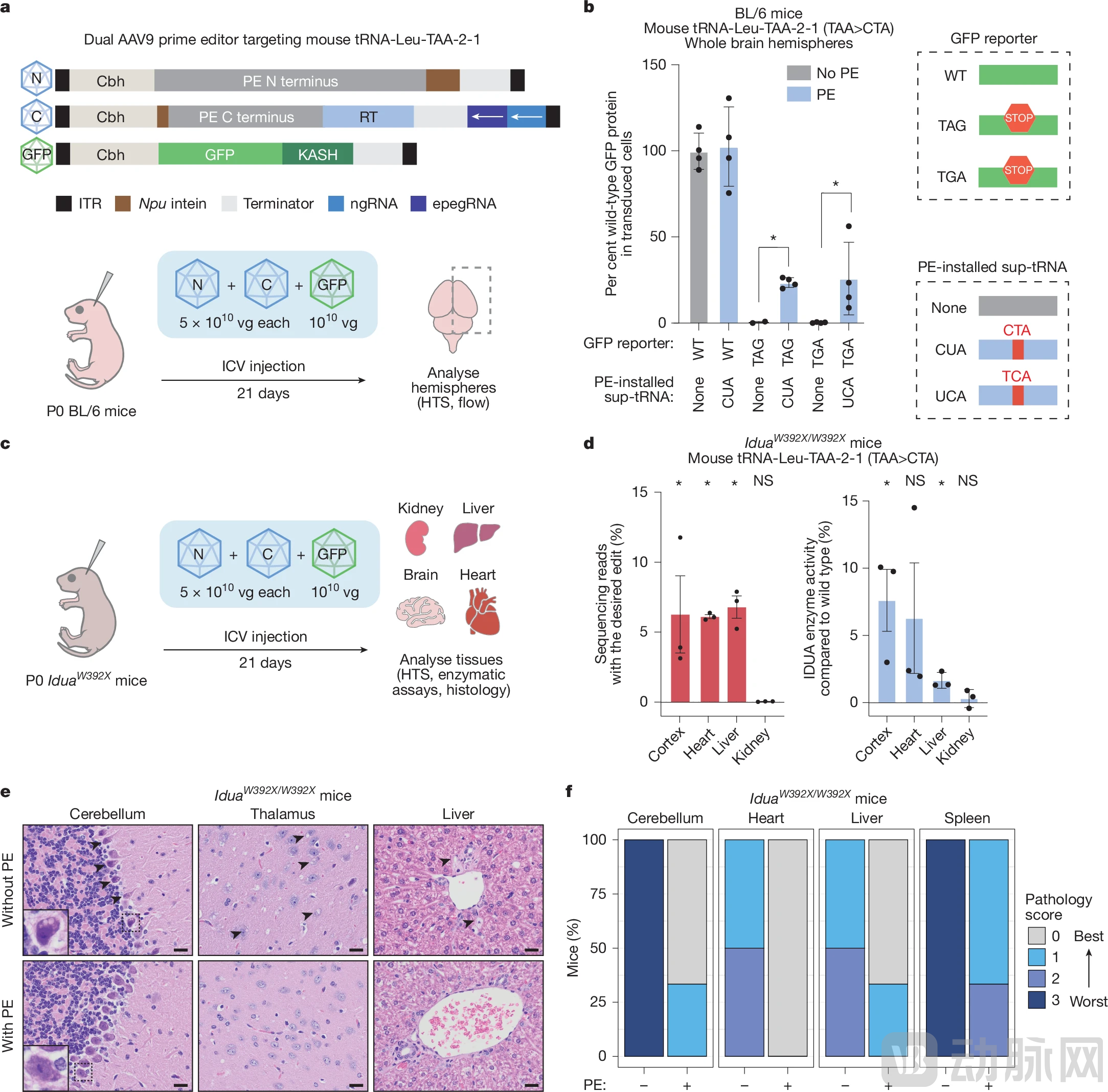
图:Prime编辑产生功能性sup-tRNA,在动物疾病模型中发挥作用(来源:Nature)
这一结果表明该工具对于许多遗传疾病并不需要完全恢复正常的蛋白质水平就能产生临床获益,这大大拓宽了PERT的治疗窗口。
对于任何基因编辑疗法,安全性都是首要关切。研究团队也进行了全面的安全性评估,通过全蛋白质组质谱分析,研究人员评估了使用TAG终止密码子的69种最丰富的人体蛋白质,结果显示sup-tRNA并未导致天然终止密码子的显著通读。
在人类细胞和小鼠的肝脏、大脑皮质组织中进行的全转录组和全蛋白质组分析也均未显示显著变化,表明sup-tRNA的表达不会显著干扰正常细胞功能。在使用慢病毒进行的脱靶筛选中也显示,Prime编辑器未产生显著的脱靶编辑。
这些安全性数据都为PERT的临床转化奠定了重要基础。
PERT最重要的突破在于其疾病无关性。传统的基因编辑疗法需要为每个致病突变设计特异性的治疗方案,这意味着即使两个患者都患有囊性纤维化,如果他们的突变位点不同,也可能需要不同的治疗。
而PERT则打破了这一限制:只要是由相同类型的终止密码子(如TAG)引起的无义突变,无论在哪个基因、导致哪种疾病,原则上都可以用同一个PERT工具治疗。
考虑到无义突变占已知致病突变的24%,PERT有潜力治疗数百种遗传疾病,覆盖大量患者群体。这将极大降低药物开发成本和时间,使更多罕见病患者能够获得治疗机会。
而且与需要重复给药的脂质纳米颗粒方法不同,PERT通过基因编辑实现了一次性永久治疗。一旦内源性tRNA被成功转换为sup-tRNA,患者的细胞将在整个生命周期内持续产生这种治疗性tRNA,无需反复治疗。这不仅减轻了患者负担,也大大降低了长期治疗成本。
David Liu描绘了一个令人憧憬的未来愿景:“有一天,医疗中心可以在冰箱里准备一套PERT药物,随时可以使用。这就是梦想。”在这个愿景中,当一个患有无义突变相关疾病的患者来到医院,医生只需确定其突变的终止密码子类型(TAG、TAA还是TGA),就可以从储备的PERT工具库中选择相应的治疗方案,实现快速、标准化的治疗。
正如汉堡大学生物化学家Zoya Ignatova评价的那样:“很高兴有另一项新技术。这将增加这些方法之一进入临床的机会。”她同时也参与了抑制性tRNA疗法的开发。
不过,Ignatova也提醒说,抑制性tRNA可能比最初看起来更为复杂。一个给定的sup-tRNA并不能对所有无义突变都有效。此外,不同组织中最佳的tRNA水平可能不同,这意味着为治疗肺部开发的sup-tRNA疗法在肝脏中可能不够安全或有效。“不会是一个tRNA治疗所有情况,”她说。
David Liu也坦言,距离PERT真正用于患者治疗还需要数年时间。“这需要数年才能达到这样的现实,但至少这项工作表明,在生物学上这是可能的。”他说。
总的来说,PERT的出现标志着治疗性基因编辑进入了一个新阶段。从早期的基因敲除,到精确的修改,再到现在的疾病无关性策略,基因编辑技术正在从个性化定制走向模块化通用。
正如David Liu所说,“疾病无关性方法”代表了治疗性基因组编辑的一个令人激动的新方向。虽然从实验室到临床还有漫长的路要走,但PERT已经证明了生物学可行性。在不远的将来,当医疗中心真的能够储备一套现成的PERT工具时,数百种遗传疾病的患者将迎来他们的治疗曙光。




























