焦虑症是全球最常见的精神健康问题,据世界卫生组织数据,全球约有3.59亿人受其影响,占全球人口的约4.4%。但是,长期以来,科学家对焦虑在大脑中的根源了解有限,现有治疗药物几乎完全针对神经元,而许多患者对这些治疗反应不佳。
不久前,犹他大学研究团队在《分子精神病学》(Molecular Psychiatry)期刊发表的一项研究改变了对焦虑调控机制的认知。
这项由诺贝尔奖得主Mario Capecchi教授领衔的研究发现,调控焦虑的关键角色并非传统认为的神经元,而是大脑中的免疫细胞——小胶质细胞。研究表明,两种不同的小胶质细胞群体以加速器和刹车的方式协同工作,调节焦虑水平。
研究第一作者Donn Van Deren博士表示:“这是一个范式转变,它表明当大脑的免疫系统存在缺陷且不健康时,可能导致非常特定的神经精神疾病。”这一发现为开发新型焦虑治疗方法提供了理论基础。

(来源:Molecular Psychiatry)
传统观点认为,焦虑主要由神经元及其神经回路调控,因此从选择性5-羟色胺再摄取抑制剂到苯二氮䓬类药物,几乎所有抗焦虑药物都以神经元为靶点。
但是,这种以神经元为中心的治疗策略忽略了大脑中另一类细胞——小胶质细胞。小胶质细胞是大脑中的免疫细胞,传统上被认为主要负责清除病原体和细胞碎片。
犹他大学研究团队在前期工作中观察到一个现象:当干扰小鼠大脑中一种特定的小胶质细胞亚群(Hoxb8小胶质细胞)时,小鼠表现出焦虑行为;但当同时抑制所有小胶质细胞的活性时,小鼠的行为反而恢复正常。这一结果提示,不同的小胶质细胞群体可能在焦虑调控中发挥相反的作用。
研究团队通过追溯小胶质细胞的发育起源来理解这个问题。早期研究发现,小鼠的小胶质细胞来自两个具有不同发育时间和迁移路径的造血祖细胞池。第一类是非Hoxb8小胶质细胞,在胚胎第7.5天产生于卵黄囊,随后直接迁移进入发育中的大脑,占成年大脑小胶质细胞总数的约75%;第二类是Hoxb8小胶质细胞,它们晚一天产生,经历更复杂的迁移路径:先迁移到主动脉-性腺-中肾区域和胎肝并大规模扩增,然后从胚胎第12.5天开始进入大脑,最终占据约25%的比例。
这两种小胶质细胞在分子水平上高度相似,只有约20个基因存在差异表达,都表达相同的小胶质细胞特异性标记物,如Tmem119和P2ry12,证实它们都是真正的实质小胶质细胞。
而两种群体在功能上的差异成为研究的关键问题。
研究团队关注Hoxb8小胶质细胞源于一个观察:当Hoxb8基因被破坏时,小鼠会出现慢性焦虑和病理性过度梳理两种病理行为,包括过度梳理行为类似于人类的拔毛癖,属于强迫症谱系障碍。大脑中唯一被Hoxb8谱系标记的细胞就是Hoxb8小胶质细胞,这提出了核心问题:缺陷性的Hoxb8小胶质细胞是否就是导致这些行为异常的直接原因?
为回答这个问题,研究团队设计了细胞移植实验——将纯化的特定小胶质细胞亚群移植到缺乏小胶质细胞的小鼠大脑中,直接观察这些细胞在行为调控中的因果作用。通过这些实验,研究团队证明了缺陷性Hoxb8小胶质细胞是病理行为的直接原因,并发现了小胶质细胞调控焦虑的“加速器/刹车”机制。
细胞移植是直接证明特定细胞在疾病中因果作用的有效手段。首先,他们利用CRISPR-Cas9技术删除Csf1r基因的FIRE增强子元件,生成了Csf1rΔFIRE/ΔFIRE小鼠。这种小鼠完全没有可检测到的内源性小胶质细胞,但可以存活到成年并繁殖,为移植实验提供了理想的受体系统。
研究人员从不同来源纯化了两种小胶质细胞群体:从胚胎胎肝中提取Hoxb8小胶质细胞祖细胞,从新生小鼠大脑中分离成熟的Hoxb8和非Hoxb8小胶质细胞。通过流式细胞分选技术和特异性荧光标记,他们将两种细胞群体分离开来,然后将约2.5万个纯化细胞双侧注射到新生小鼠的大脑中。选择新生期进行移植是因为此时血脑屏障尚未完全成熟,移植细胞更容易进入并分布到各个脑区。
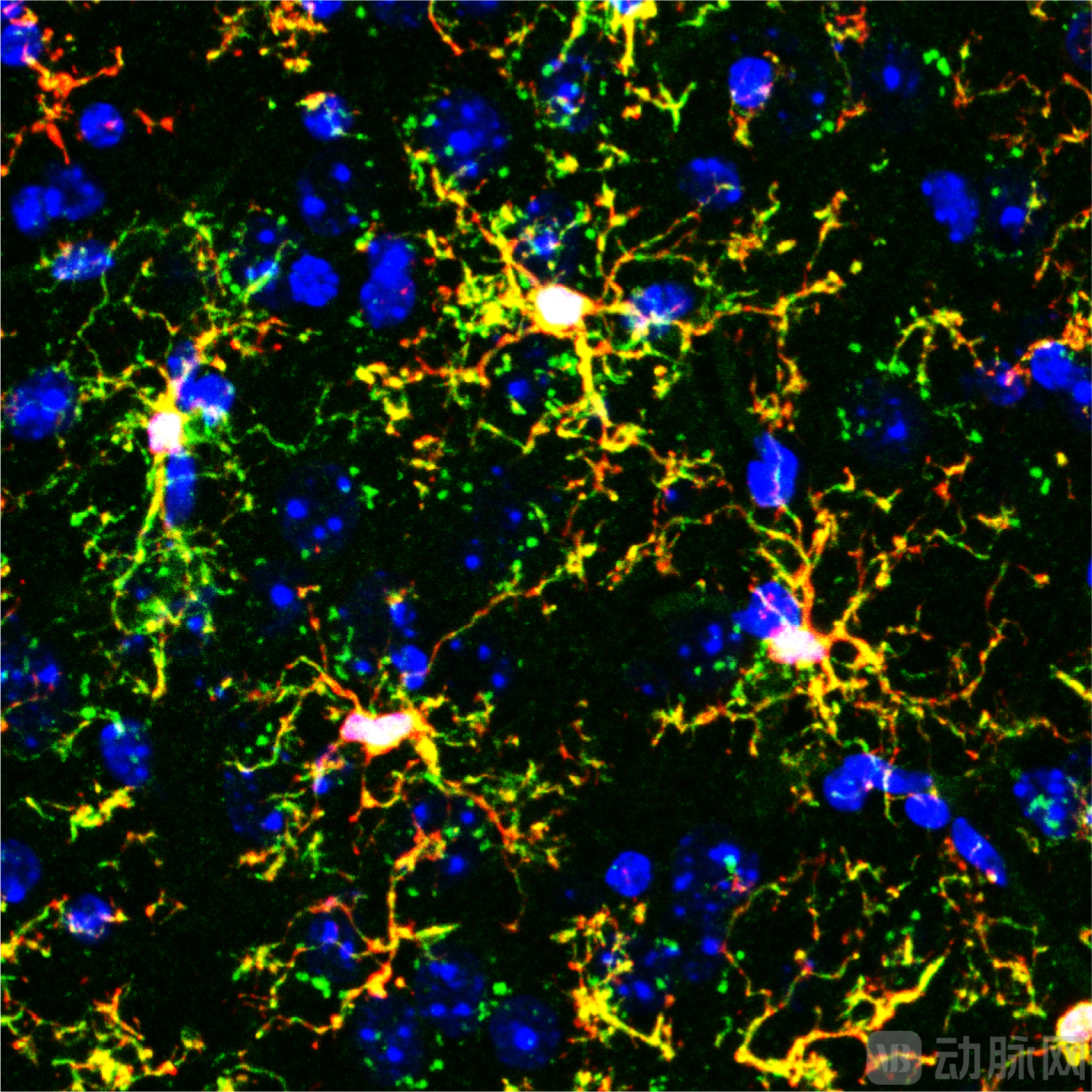
图:小鼠脑内移植的小胶质细胞(黄色分支状结构)的荧光显微镜图像(来源:University of Utah Health)
移植后的观察结果显示了明确的因果关系。研究团队设计了三组实验:假手术对照、野生型Hoxb8小胶质细胞移植、突变型Hoxb8小胶质细胞移植。在小鼠成熟后,只有接受突变型细胞的小鼠表现出明显的毛发脱落,脱落模式与自然发生的Hoxb8突变小鼠相似。行为学测试进一步证实:接受突变型细胞的雌性小鼠在两小时内梳理时间达1292秒,而野生型移植组仅562秒;在高架十字迷宫实验中,突变型组在开放臂中仅停留25%的时间,而对照组停留约53%。
这些数据表明,缺陷性Hoxb8小胶质细胞直接导致了慢性焦虑和病理性过度梳理,首次明确证明了大脑免疫细胞在精神疾病中的因果作用。
基于前期线索,研究团队提出了一个假设:两种小胶质细胞可能作为二元对抗系统,Hoxb8小胶质细胞充当“刹车”抑制焦虑,而非Hoxb8小胶质细胞充当“加速器”促进焦虑。这个模型预测,只含野生型非Hoxb8小胶质细胞的小鼠(完全缺乏“刹车”)应该表现出病理性高水平的焦虑和梳理。为了验证这一预测,他们将仅Hoxb8细胞、仅非Hoxb8细胞,以及两者的混合物(25:75比例)分别移植到受体小鼠中。
进一步的实验结果支持了模型预测。仅非Hoxb8组的雌性小鼠梳理时间达约2400秒,远高于仅Hoxb8组(约600秒)和混合组(约500秒);在明暗箱测试中,仅非Hoxb8组在明亮区域仅停留约60秒,显著少于其他组(90-100秒)。接受混合移植的小鼠表现正常,表明当“加速器”和“刹车”都存在时,系统达到了平衡。这些结果表明,小鼠通过由两种功能相反的小胶质细胞构成的二元调控系统来调节焦虑和梳理行为。
为了验证移植细胞的功能性,研究团队进行了多层次验证。免疫组化分析显示,移植细胞表达了所有成熟标记物(Tmem119、P2ry12、Iba1),形态呈现典型的分支化特征;光遗传学实验提供了更直接的证据:当用蓝光刺激表达通道视紫红质的移植Hoxb8小胶质细胞时,小鼠的梳理行为立即显著增加,而对照组无反应。这证明了移植细胞具有功能性,并表明它们与神经元建立了功能性相互作用。
深入分析数据时,研究团队发现了一个现象,仅含非Hoxb8细胞的小鼠虽然表现出病理行为,但严重程度仍低于Hoxb8突变小鼠。雌性仅非Hoxb8组梳理1050秒,而突变组梳理1490秒,差异达440秒。这表明Hoxb8基因突变不仅导致功能丧失(细胞缺失),还产生功能获得成分(突变蛋白干扰其他过程)。量化分析显示,功能丧失贡献约450秒增加,功能获得贡献约440秒,两者几乎相当。这一发现提示,理想的治疗方法可能需要同时解决功能丧失和功能获得两方面的问题。
这项研究代表了神经精神病学研究的范式转变——从以神经元为中心的观点,转向认识到免疫系统在大脑功能和行为调控中的核心作用。
资深作者Mario Capecchi教授指出:“人类也有两种功能相似的小胶质细胞群体。”如果这一推测得到证实,针对小胶质细胞的治疗策略可能为患者带来新的选择。潜在的治疗方向包括增强Hoxb8样小胶质细胞功能、抑制非Hoxb8样细胞过度活性,或通过药理学手段恢复两者平衡。
此外,这一发现也可能对理解其他精神疾病具有意义。小胶质细胞功能障碍能够导致焦虑和强迫行为,是否也参与了抑郁症、自闭症谱系障碍、精神分裂症等疾病的发病?而越来越多的证据表明,许多精神疾病都伴随着神经炎症和免疫系统异常。
不过,将这些发现转化为临床应用仍面临多方面挑战:如何在不影响外周免疫系统的情况下选择性调节大脑中的特定小胶质细胞亚群?如何突破血脑屏障递送治疗分子?长期调节免疫系统的安全性如何保障?
第一作者Donn Van Deren博士表示:“我们距离治疗方面还很远,但在未来,人们可能能够靶向大脑中非常特定的免疫细胞群体,并通过药理学或免疫治疗方法纠正它们。这将是治疗神经精神疾病方式的重大转变。”

图:诺奖得主、论文通讯作者 Mario Capecchi 教授正在标注大脑中小胶质细胞的示意图(来源:University of Utah Health)
而未来研究的问题包括:两种小胶质细胞如何通过分子信号调控神经回路?人类是否真的拥有功能相反的两种小胶质细胞群体?如何在活体中识别和评估它们的状态?这些问题的解答将为临床试验提供基础。
总的来说,犹他大学这项发表在《分子精神病学》上的研究,通过实验设计和技术手段,揭示了大脑免疫系统在焦虑调控中的作用,提出并验证了小胶质细胞“加速器/刹车”的二元调控模型。这一发现深化了对焦虑产生机制的理解,为开发新型治疗方法提供了方向。
Mario Capecchi教授表示:“这些知识将为失去控制焦虑水平能力的患者提供重获控制的手段。”从基础研究到临床应用还有很长的路要走,但这项研究代表了神经精神病学领域的一个里程碑。它表明,免疫系统与神经系统之间存在着复杂的相互作用,理解这些相互作用可能是攻克焦虑症、强迫症等精神疾病的关键所在。




























