当新的致命病毒突然出现时,我们能否在几周内就设计出有效的治疗性抗体?要知道,传统的抗体开发,需要免疫动物、筛选大量细胞、进行无数次实验验证,这一过程往往需要数月甚至数年时间。但现在,一项发表在顶级期刊Cell上的突破性研究正在改写这一规则。
来自范德比尔特大学医学中心的Ivelin S. Georgiev团队开发了一个名为MAGE(单克隆抗体生成器)的人工智能系统,成功实现了人类抗体的“从零设计”。相关成果于2025年11月4日发表在顶级期刊Cell杂志上。

(来源:cell)
这项研究最重要的贡献在于:它借鉴了Transformer蛋白语言模型的核心技术,将其应用到生物医药领域,并验证了AI可以通过学习序列规律完成“设计生命”的任务。
更重要的是,研究团队不仅在计算机上实现了这一突破,还通过严格的实验验证,证明MAGE设计的抗体能够有效对抗新冠病毒(SARS-CoV-2)、新兴禽流感(H5N1)和呼吸道合胞病毒(RSV-A)等多种威胁人类健康的病原体。
难题一:传统方法的困境
抗体药物被誉为生物医药领域的“导弹”,能够精准识别并消灭致病靶点,然而传统的抗体开发过程极其繁琐——
时间成本高:从靶点确认到获得候选抗体,往往需要数月甚至更长时间;
经济成本高:涉及动物免疫、细胞培养、高通量筛选等昂贵环节;
成功率低:大量候选抗体在后续验证中失败,真正能进入临床的寥寥无几;
应急能力弱:面对突发疫情,传统方法难以快速响应。
现有的AI辅助方法虽然能够在一定程度上改进效率,但多半局限于优化已有抗体或依赖起始模板,距离真正意义上的从零设计仍有明显差距。
难题二:抗体设计的复杂性
抗体并非单一的蛋白质链,而是由两条重链和两条轻链精密配对而成的复杂分子。这种配对关系对抗体的功能至关重要——轻链和重链必须完美匹配,才能形成有效的抗原结合位点。这就像要同时设计两把钥匙,让它们协同作用才能打开同一把锁。
传统AI方法往往只能设计其中的某些片段(如互补决定区CDR),而无法生成完整的、配对的重链-轻链组合,这大大限制了其实用价值。
面对这些挑战,MAGE实现了三个关键突破:
首先,MAGE实现了无需起始模板的全新设计能力。研究者只需输入病毒蛋白(抗原)的氨基酸序列,模型便可自动生成覆盖重链和轻链全部可变区的完整抗体序列,相当于根据抗原信息直接构建匹配的分子方案。
其次,模型通过独特的序列编码方式同步生成配对链,确保重链与轻链之间的兼容性。训练数据中使用的特殊分隔标记让模型能够学习轻链、重链与抗原之间的协同关系,从而输出更符合生物学约束的序列。
最后,MAGE在Progen2这一大型蛋白质语言模型的基础上完成微调。Progen2在超过10亿条蛋白质序列上预训练,具备对蛋白序列规律的广泛理解,研究团队再以18507对抗体-抗原序列对进行定向训练,使其掌握抗体设计的任务特征。
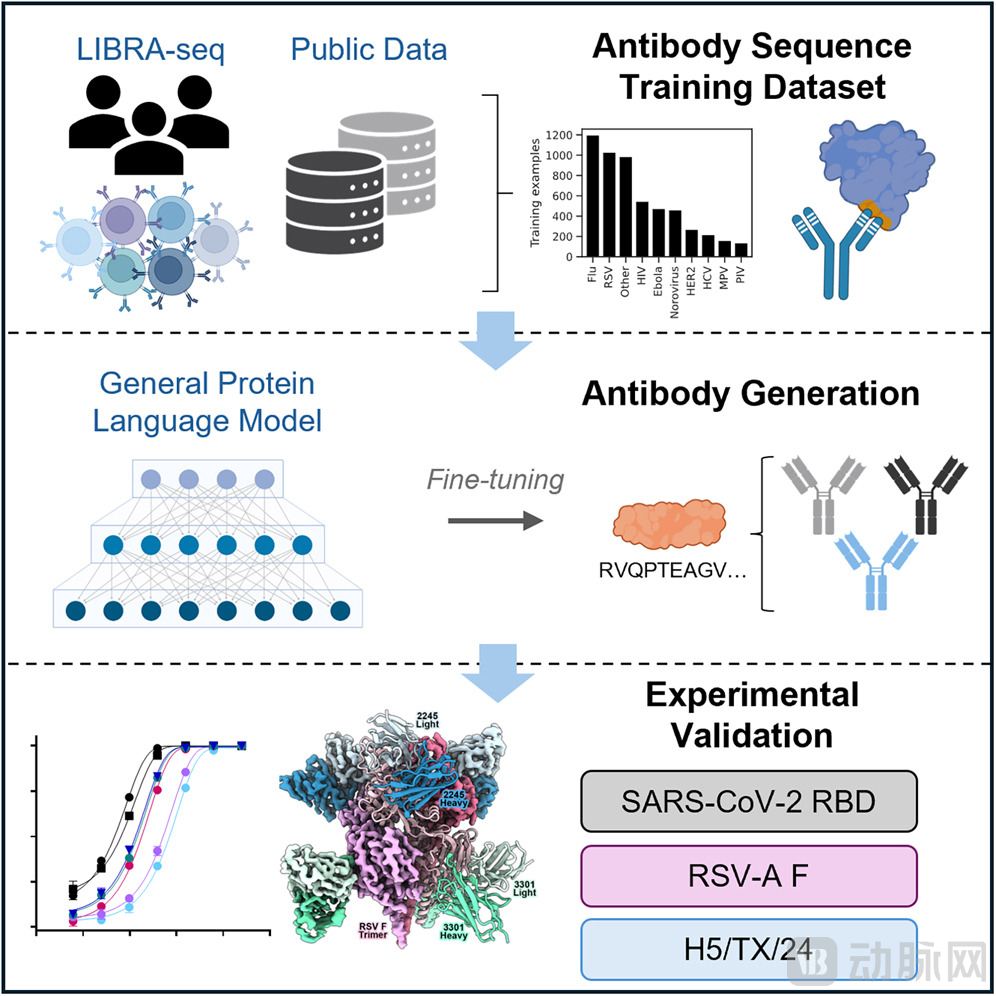
图:MAGE设计抗体流程(来源:cell)
这些创新背后的工作方式可以用一个通俗的类比来理解。
传统抗体发现更像是“相亲”——需要让成千上万的候选抗体与病毒“见面”,通过实验去验证是否“来电”,既耗时又昂贵;MAGE则扮演“媒人”,通过学习大量成功配对案例,归纳出什么样的抗体容易和什么样的抗原匹配,从而在给出新的病毒蛋白时直接提出可能有效的设计。
AI设计抗体并不是新闻,但能否真正产生有效的抗体才是关键。MAGE的价值在于,研究团队进行了全面而严格的实验验证。
针对新冠病毒:45%成功率
研究团队首先选择了SARS-CoV-2的RBD(受体结合域)作为靶点——这是病毒入侵人体细胞的关键部位。MAGE生成了1000个候选抗体序列,经过初步筛选后,研究人员挑选了20个进行实验验证。
实验结果显示,9个抗体(45%)具有可检测的结合能力,其中8个抗体的结合亲和力达到纳摩尔甚至亚纳摩尔级别。进一步的功能评估表明,有4个抗体具备病毒中和能力,RBD-409是表现最突出的样本。该抗体的IC50为6.7 ng/mL,在低浓度条件下即可抑制病毒感染,并且对Delta、Gamma、Omicron等多个变异株保持中和活性,体现出广谱效应。序列比对显示,RBD-409与训练数据集中最相似抗体之间仍存在平均13个氨基酸差异,说明MAGE能够输出具有新颖序列特征的分子设计,而非简单复刻既有样本。
成功对抗新兴禽流感
在H5N1禽流感实验中,MAGE针对2024年出现的H5/TX/24(A/Texas/37/2024)新毒株生成序列,而这一毒株在模型训练阶段尚未出现,因此相当于零样本测试。研究人员从18个候选抗体中筛选出5个具有强结合(28%),另有7个表现出较弱结合;所有强结合样本的IC50均低于1 μg/mL,具备可观的中和活性,并对不同的H5和H1流感亚型呈现多样化中和模式。该实验说明模型能够在缺乏直接训练样本的情况下迁移已有知识,对新兴病原体生成具有功能性的抗体序列。
挑战低代表性靶点:RSV-A验证
为了评估在数据稀缺情形下的表现,团队还选择了训练集中代表性仅为新冠病毒十分之一的RSV-A作为第三个靶点。在23个验证的抗体中,7个样本显示结合活性(30%),其中3个具有较强的中和能力。RSV-2245的IC50低于0.1 μg/mL,冷冻电镜结构表明其靶向RSV融合蛋白的关键位点V;RSV-3301则是验证集中突变程度最高的抗体,结构显示其以不同于既往报道的方式结合位点I,为靶向前融合构象的RSV-F蛋白提供了新的结合模式。
MAGE的直接价值是压缩抗体研发时间并降低成本:传统流程往往需要半年以上才能获得候选分子,而MAGE在数小时内即可生成上千条序列,经计算筛选后只需对少量高潜力候选进行实验,整体周期缩短至数周甚至数天,也减少了对动物实验和大规模筛选的依赖。
模型的“零样本”能力为公共卫生应急提供了新路径。只要获得新病原体的基因序列,即可立刻启动抗体设计流程,在大流行早期为治疗性抗体储备赢得时间,理论上有助于提升大规模疫情中的响应效率。
从长远看,这一技术路线与个性化医疗高度契合:通过对不同人群、不同疾病靶点的序列输入,有机会为罕见病患者、肿瘤免疫治疗或特定人群疾病设计专属抗体,让抗体药物开发更加定制化和可扩展。
不过,MAGE从研究成果到广泛应用仍面临一些挑战。
比如目前28-45%的结合率虽优于部分传统流程,但意味着多数候选仍需淘汰,成功率有待提升;性能受到训练数据分布的影响,在与训练集差异较大的靶点上可能下降;生成的序列仍需依赖大量实验验证,尚不能脱离实验环节。
研究团队也在论文中展望,随着数据积累和技术进步,未来的MAGE可能真正学会抗体-抗原相互作用的通用规律,实现对完全未见过的靶点的有效设计。
MAGE的出现标志着抗体药物研发进入了AI驱动的新时代。它证明了大语言模型的核心技术不仅能理解人类语言,也能理解“生命的语言”。
虽然距离完全取代传统方法仍有差距,但MAGE已经展示了较高的潜在效率:能够以更快、更低成本和更可控的方式设计抗体,为应对当前和未来的健康威胁提供新的技术路径。
当我们讨论人工智能如何改变世界时,MAGE这类研究表明,AI的核心价值在于帮助解决生命科学中的复杂问题。在这一意义上,MAGE既是技术层面的突破,也为未来的疾病防治提供了新的手段。




























