在脑机接口(Brain-Computer Interface, BCI)领域,如何在降低手术侵入性的同时保持高质量的神经信号记录,一直是一个巨大的挑战。传统的非侵入式技术虽然安全但信号分辨率有限,而侵入式技术虽然信号清晰却伴随着组织损伤和感染风险。
2025年12月8日,哥伦比亚大学肯·谢泼德(Ken Shepard)教授团队与斯坦福大学、纽约长老会医院等机构合作,在《自然-电子学》(Nature Electronics)期刊上发表了一项突破性研究。该团队开发了一种名为“皮层生物电子接口系统”(Bioelectronic Interface System to the Cortex, BISC)的新型无线脑机接口。

(来源:Nature Electronics)
这种单芯片设备集成了65,536个记录电极,能够以极高的时空分辨率捕捉大脑皮层活动,同时实现了完全植入和无线供电,为高通量、微创的脑机接口技术开辟了新的道路。
BISC系统的成功研发标志着脑机接口技术正式迈入了“单芯片、高通量、全无线”的新时代。它巧妙地解决了植入体积、信号质量与手术创伤之间的矛盾,以微米级的精度为我们打开了一扇通往大脑内部世界的清晰窗口。随着技术的不断成熟和临床转化的推进,这一微小的硅芯片有望成为连接人类思维与数字世界的桥梁,为无数受神经疾病困扰的患者带来重生的希望。
皮层电图(Electrocorticography, ECoG)是一种使用嵌入在柔性基底层中的非穿透性电极来记录大脑表面电活动的技术。与穿透式电极相比,ECoG位于皮层表面,能显著减少对脑组织的损伤,同时相比头皮脑电图(EEG)又能提供更高的信噪比和带宽。
然而,现有的高分辨率ECoG阵列虽然已能在单个基底上提供数千个记录点,但其信号调理和数据传输仍依赖于分立的电子元件。传统的有线连接不仅限制了受试者的活动范围,还增加了感染风险。即便是现有的无线解决方案,往往也受限于体积庞大的电子封装或“罐体”设计,导致手术植入复杂且长期稳定性受限。更关键的是,这种分立式设计限制了记录通道的数量和设备的扩展性,难以满足对大脑复杂时空动态进行精细观测的需求。
为了解决这些问题,研究团队采取了将电极与电子电路完全集成在同一块芯片上的策略。
BISC系统的核心是一个面积为12×12毫米的互补金属氧化物半导体(Complementary Metal-Oxide-Semiconductor, CMOS)芯片。通过后处理工艺,芯片被减薄至不足50微米,使其具有足够的机械柔性,能够紧密贴合大脑皮层的弯曲表面。这种高度集成的设计使得BISC在体积效率(Volumetric Efficiency)——即单位植入体积内的记录通道数——上取得了质的飞跃。
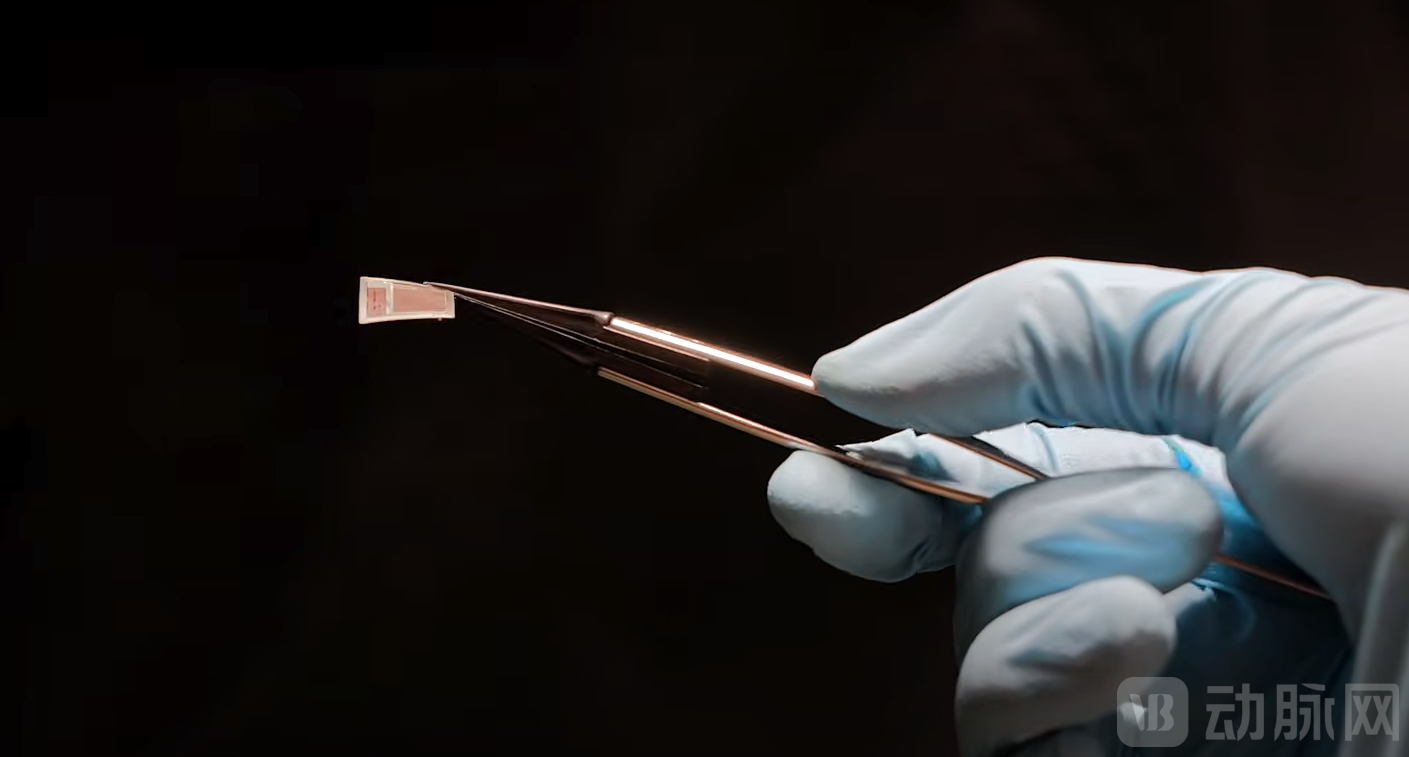
(来源:Columbia Engineering)
数据显示,BISC的体积效率比目前最先进的竞争对手高出400倍以上。这种单芯片架构不仅消除了繁杂的连线,还通过将信号放大、滤波、模数转换等功能直接集成在电极下方的像素电路中,大幅提升了信号质量和系统集成度。
BISC系统的设计理念在于实现极致的微型化和高性能的统一。它不仅是一个记录设备,更是一个完整的双向神经接口平台。通过外部的可穿戴“中继站”(Relay Station),BISC可以实现无线供电和高达108 Mbps的高带宽数据上行传输。这种无线连接基于超宽带(Ultra-Wideband, UWB)脉冲无线电技术,能够在保证低功耗的同时,实时传输海量的神经数据。
而且这种“纸一样薄”的设备可以像一张湿润的纸巾一样轻柔地滑入硬脑膜下空间,无需进行复杂的开颅手术或去除大块骨骼,极大地降低了手术风险,并为未来的微创植入奠定了基础。
BISC系统的性能在多项动物实验中得到了严格验证。该芯片集成了65,536个氮化钛(Titanium Nitride, TiN)电极,尽管由于数据带宽限制不能同时记录所有电极,但系统允许用户在任意时刻从这6.5万个电极中选择1,024个通道进行同时记录。
在猪模型的体感诱发电位(Somatosensory Evoked Potentials, SSEP)实验中,研究人员在猪的鼻吻部不同位置进行刺激,BISC成功记录到了由此引发的皮层电位变化。通过t-分布随机邻域嵌入(t-SNE)分析,记录到的信号呈现出清晰可分的聚类,线性判别模型的分类准确率高达97.8% ± 1.7%,证明了该系统在捕捉精细触觉空间分布上的卓越能力。组织学检查显示,植入区域未见明显的病理损伤,证实了其良好的生物相容性。
在非人灵长类动物(Non-Human Primate, NHP)模型中,研究团队进一步展示了BISC在运动和视觉解码方面的潜力。在一项运动任务中,猕猴进行非同步的伸手抓取动作,BISC记录了运动皮层(M1)和体感皮层(S1)的神经活动。解码器利用局部场电位(Local Field Potentials, LFP)信号成功预测了手臂的运动速度,皮尔逊相关系数达到0.53。更引人注目的是在视觉皮层的长期记录(长达64天)。研究人员向猕猴展示光栅、随机点和自然图像等视觉刺激,BISC不仅精准绘制了初级视觉皮层(V1)的视网膜拓扑图(Retinotopic Map),还捕捉到了微米尺度的“行波”(Travelling Waves)。这些行波是神经振荡在空间上传播的相干模式,此前仅在厘米或毫米尺度上被观测到。
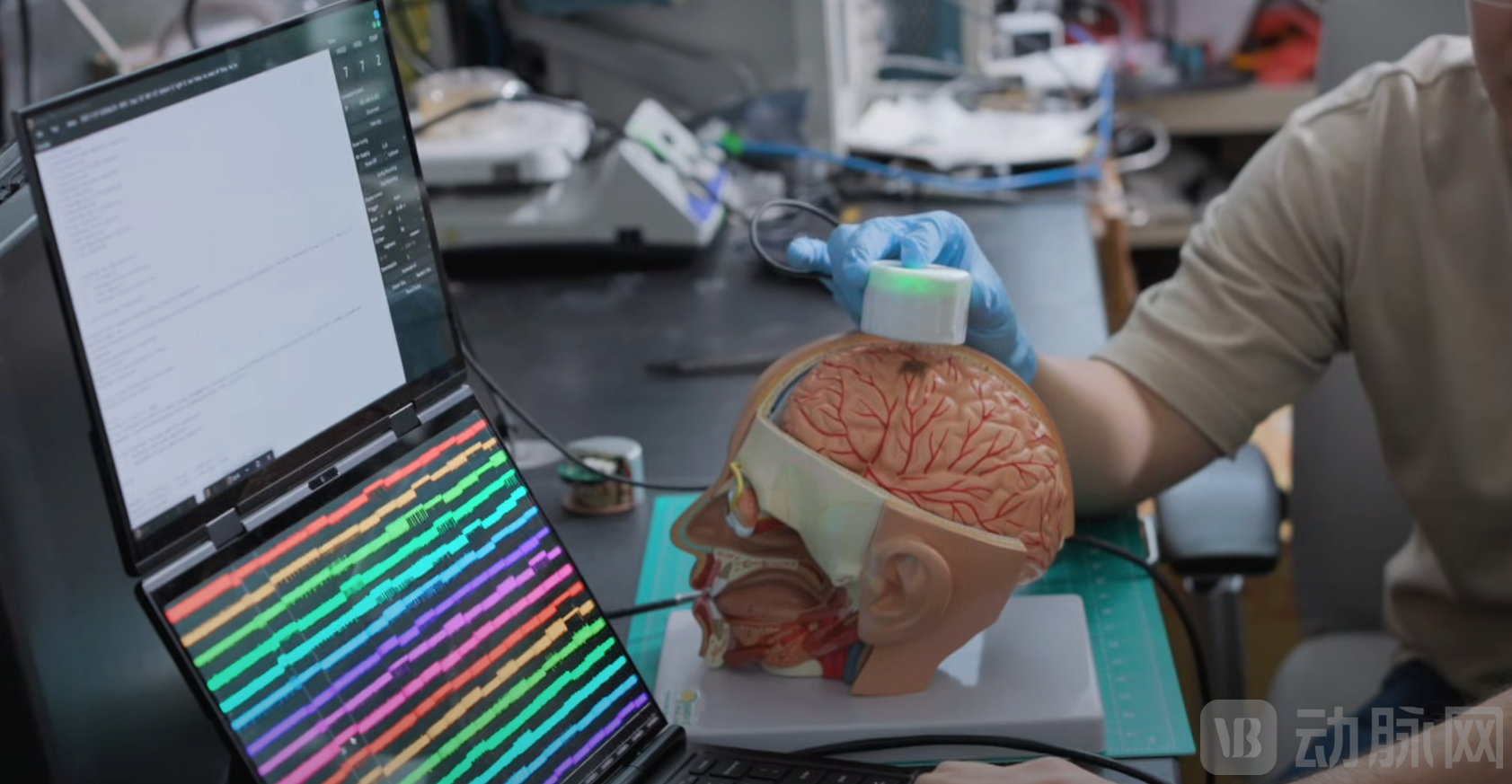
(来源:Columbia Engineering)
利用BISC的高密度记录优势,研究人员发现这些γ波段(30-90 Hz)的行波携带着关于视觉刺激位置的丰富信息。通过构建包含卷积神经网络(CNN)和Transformer及混合架构的解码模型,他们发现利用高分辨率的行波数据可以显著提高对视觉刺激位置的解码精度(p < 0.01)。
此外,通过“数字孪生”(Digital Twin)模型——一种基于深度神经网络的预测模型,研究人员还能针对每个记录通道生成“最大兴奋图像”(Maximally Exciting Images, MEIs),从而揭示出从V1到V4皮层区域神经元对视觉特征选择性的层级变化。V1区域表现出对特定方向光栅的偏好,而V2和V4区域则对更复杂的颜色对抗特征敏感。这些发现充分展示了BISC在解析大脑精细时空动态方面的强大能力。
BISC技术的问世不仅在工程学上具有里程碑意义,更为基础神经科学研究和临床治疗带来了新的希望。
从理论层面看,BISC提供的前所未有的高时空分辨率,使得科学家能够首次在微米尺度上观测大脑皮层的行波等动态模式。这填补了连接微观神经元活动与宏观脑区功能之间的空白,有助于我们更深入地理解大脑如何通过大范围的协调活动来处理信息。
正如哥伦比亚大学生物医学工程教授肯·谢泼德所言:“我们将所有功能集成在一块硅片上,展示了脑机接口如何变得更小、更安全,同时功能更强大。”这种将计算能力微缩植入体内的能力,预示着未来医疗植入物将不再受限于体积,而是像高性能计算机一样强大且隐形。
在临床应用方面,BISC的微创特性使其极具吸引力。传统的侵入式电极往往需要穿透脑组织,容易引发免疫反应和胶质瘢痕,导致信号质量随时间下降。而BISC作为一种硬脑膜下植入物,既避免了穿透损伤,又比硬脑膜外电极更贴近神经元,从而保证了长期稳定的高信噪比记录。
其“可滑动”的植入方式意味着未来可能只需在头骨上开一个微小的切口即可完成植入,大大降低了手术创伤和并发症风险。这一特性对于治疗药物难治性癫痫、瘫痪、失语症以及盲人视觉恢复等慢性神经系统疾病具有重要意义。特别是对于癫痫患者,BISC的高密度阵列可以更精准地定位癫痫灶,为精准治疗提供依据。
目前,基于BISC技术的初创公司Kampto Neurotech已经成立,正致力于将这一科研成果转化为临床产品。
虽然目前的体外中继站体积仍有缩小的空间,且系统目前尚未开展人体试验,但其展现出的可扩展性和模块化设计为未来的应用提供了无限可能。研究团队计划未来通过平铺多个芯片来覆盖更大的脑区,并通过连接聚酰亚胺扩展器来适应深部脑刺激的需求。
随着AI技术与脑机接口的深度融合,BISC所代表的高带宽、双向交互模式,将使人类与AI系统的无缝连接成为可能,不仅用于治疗疾病,更有望增强人类的认知与感知能力,重新定义人机交互的未来。




























