T细胞免疫疗法(T cell Immunotherapy)在过去十年中已成为癌症治疗领域最令人振奋的突破之一。通过重新编程患者自身的免疫系统来精准识别并摧毁癌细胞,这种疗法为无数晚期肿瘤患者带来了生的希望。
然而,尽管取得了显著的临床成功,科学家们对T细胞究竟是如何在分子层面被“点亮”或“激活”的,仍存在巨大的认知空白。这种基础机制认知的缺失,在一定程度上限制了该疗法的广泛应用——目前,它仅对少数类型的癌症有效,而对大多数实体瘤仍束手无策。
2025年12月16日,来自洛克菲勒大学(Rockefeller University)Thomas Walz 团队的一项重磅研究发表于权威期刊 Nature Communications。

(来源:The Rockefeller University官网)
研究团队利用先进的冷冻电镜(Cryo-EM)技术,首次成功解析了处于类原生膜环境——纳米盘(Nanodiscs)中的人类T细胞受体(TCR)-CD3复合物结构。
这项研究揭示了一个令人惊讶的发现:在静息状态下,TCR实际上处于一种“关闭/紧缩”构象,直到遇到危险信号(抗原)才会像“玩偶盒”(jack-in-the-box)一样瞬间弹开。这一发现不仅终结了学界关于TCR激活机制长达数十年的争论,更为设计下一代更高效、更广谱的癌症免疫疗法提供了关键的结构蓝图。
T细胞受体(TCR)是T细胞表面的“眼睛”,负责识别由其他细胞表面的人类白细胞抗原(HLA)呈递的异常信号(如病毒肽段或肿瘤抗原)。与之紧密相连的CD3蛋白复合物则负责将识别到的信号传递到细胞内部,从而引发免疫反应。
长期以来,为了研究这一复杂的膜蛋白机器,科学家们不得不使用去垢剂(detergent)将TCR-CD3复合物从细胞膜中提取出来。然而,这种处理方式破坏了蛋白原本赖以生存的细胞膜环境。在过去解析的所有结构中,TCR-CD3复合物似乎总是处于一种“开放”且“伸展”的状态。这导致了一个长期的科学谜题:如果TCR一直都是“醒着”的,它是如何区分“平静”与“危险”的?配体的结合究竟有没有引发构象改变?
“这就好比我们在真空中观察一条鱼,然后试图推断它在水里是怎么游的。”
这种实验条件的局限性,使得学术界长期以来误以为TCR在激活过程中没有发生显著的构象变化,或者认为需要其他外力(如机械力)参与。
为了还原最真实的生物学图景,Thomas Walz 团队采用了一种极具创新性的方法:他们摒弃了传统的去垢剂,转而将TCR-CD3复合物“种”在了一个微型的人造细胞膜——纳米盘(Nanodiscs)中。这种纳米盘由膜支架蛋白(MSP)包裹,内部填充了模拟T细胞原生膜环境的特定脂质混合物。
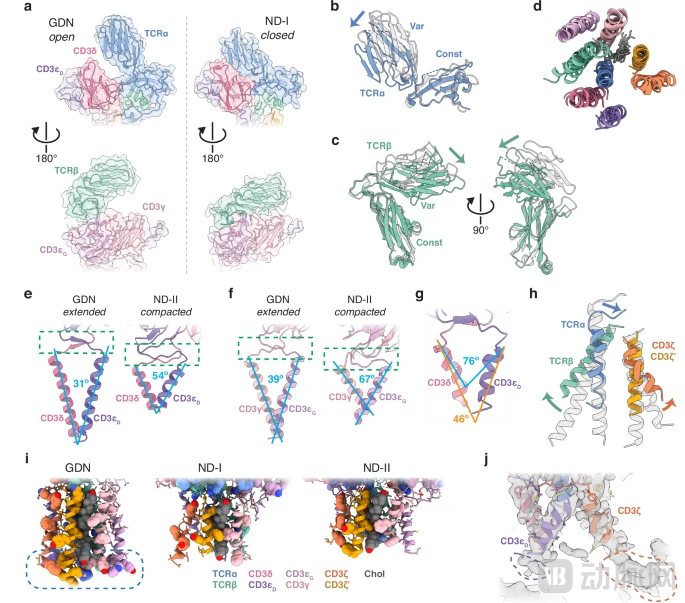
图:纳米盘中 TCR–CD3 的独特结构特征
(来源:Nature Communications)
正是在这种“回归自然”的环境中,真相浮出水面。
通过冷冻电镜(Cryo-EM)的高分辨率解析,研究团队捕获了TCR-CD3复合物在纳米盘中截然不同的两种状态。
首先是静息态下的“关闭”模式。在没有抗原刺激时,TCR-CD3复合物并不像过去认为的那样处于“松弛”状态,而是呈现出两种紧密相关的“关闭/紧缩”(closed/compacted)构象(被命名为ND-I和ND-II)。结构数据显示,TCR的胞外域紧紧贴合在CD3复合物上,不仅整体高度缩短了约35Å(埃) ,而且跨膜螺旋(TM helices)的角度也发生了显著扭转。这种紧缩状态部分是由复合物与膜脂质(包括胆固醇和特定磷脂)之间的特异性相互作用维持的。这些脂质像“胶水”一样,帮助维持了复合物的静息构象。
然而,当抗原出现时,情况发生了剧变。当研究人员向纳米盘体系中加入特异性的HLA-抗原配体后,令人惊叹的一幕发生了:TCR-CD3复合物迅速打破了原本的紧缩构象,转变为我们在去垢剂中常见的“开放/伸展”(open/extended)状态。这一过程就像是一个被压缩的弹簧或“玩偶盒”被突然释放。TCR识别抗原后,胞外域“弹起”,带动跨膜区域发生构象重排,从而将胞外的“识别信号”转化为胞内的“激活信号”。
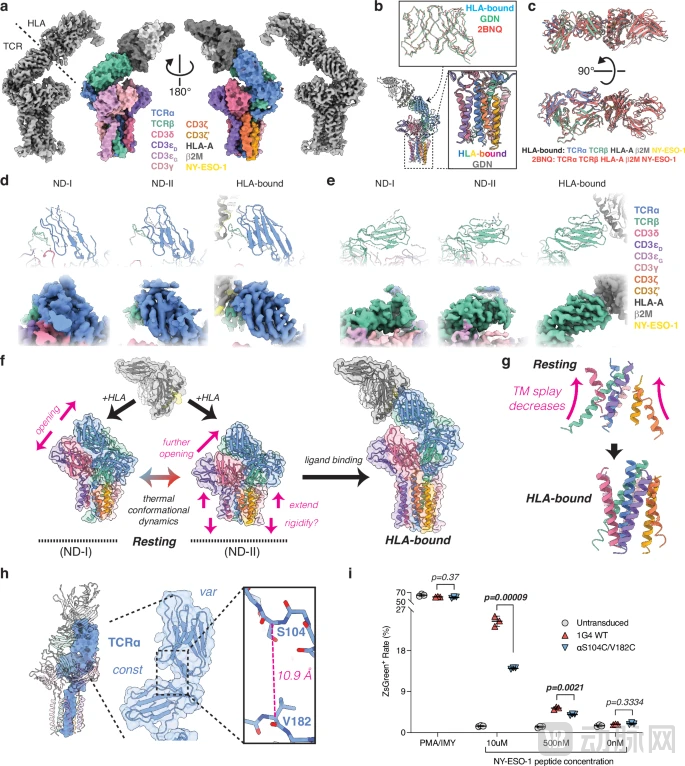
TCR-CD3 激活过程中的构象变化
(来源:Nature Communications)
为了进一步验证这一“弹簧模型”的生理意义,研究团队设计了一组精巧的实验。他们通过基因工程手段在TCR的关键部位引入了二硫键,相当于给这个“弹簧”上了一把“锁”,使其只能保持在“关闭”状态而无法弹开。结果显示,被“锁住”的TCR虽然仍能正常识别抗原,但却无法有效地激活T细胞。与野生型相比,突变体T细胞的激活水平下降了约26%至42%。这一关键证据有力地证明:从“静息态”到“激活态”的构象变化,是T细胞启动免疫反应的必要条件。
这一发现的意义远不止于解开了一个基础生物学谜题。它为临床应用,尤其是癌症免疫疗法的改进,指明了全新的方向。
重中之重在于重新通过结构设计平衡TCR的灵敏度。目前的TCR-T细胞疗法(TCR-T)面临的一大挑战是“灵敏度”的平衡。灵敏度太低,杀不死肿瘤;灵敏度太高,又可能误伤正常细胞(脱靶效应)。该研究论文的第一作者、肿瘤学家与研究员 Ryan Q. Notti 博士指出:
“既然我们知道了TCR是如何像开关一样工作的,我们就可以通过工程化改造来微调这个开关的‘阈值’。”
利用新解析的关闭态结构,科学家可以设计特定的分子或突变,来改变TCR“弹开”的难易程度。例如,对于那些肿瘤抗原表达量极低的癌症(如某些肉瘤),可以设计更容易“弹开”的TCR,从而提升疗效。
此外,这一发现也为癌症疫苗的设计提供了精确导航。除了细胞疗法,准确理解TCR与HLA-抗原复合物在膜上的动态相互作用,能帮助科学家筛选出更能有效触发TCR构象改变的抗原表位,从而设计出能诱导更强免疫反应的疫苗。
“这是我实验室有史以来最重要的工作之一,” Walz 教授评价道,“T细胞受体是几乎所有肿瘤免疫疗法的基础。令人惊讶的是,我们在使用这些工具救治病人的同时,竟然一直没搞清楚它到底是怎么工作的。而基础科学的价值正是在于此——填补认知鸿沟,推动医学飞跃。”
随着这一“隐形弹簧”机制的揭示,我们有理由相信,未来的免疫疗法将不再是“盲人摸象”,而是基于精确分子机理的理性设计。这将极大地扩展免疫疗法的适应症,让更多身患绝症的患者从中获益。




























