据《阿尔茨海默症与痴呆症》(Alzheimer's & Dementia)统计,阿尔茨海默症(Alzheimer's disease, AD)已成为全球痴呆症的主要诱因,预计到2050年将影响超过1.5亿人。长期以来,医学界普遍认为AD一旦发展到晚期便不可逆转,现有治疗手段主要集中在预防或延缓病情进展上。
然而,2025年12月发表在《细胞报告医学》(Cell Reports Medicine)上的一项重磅研究挑战了这一百年信条。来自美国大学医院(University Hospitals)、凯斯西储大学(Case Western Reserve University)的研究团队,通过调节大脑能量代谢的核心分子,不仅在小鼠模型中阻止了AD的发生,更在疾病晚期实现了病理逆转和认知功能的全面恢复。该研究由Andrew A. Pieper博士担任通讯作者,首次证明了恢复大脑烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide, NAD+)稳态是治疗AD的关键路径,为这一顽疾的治疗带来了全新的希望。

图:Andrew A. Pieper博士
(来源:University Hospitals)
阿尔茨海默症自被发现以来的一个多世纪里,始终被视为一种进行性、不可逆的神经退行性疾病。目前的临床治疗主要靶向淀粉样蛋白(Amyloid beta, Aβ)或针对症状进行干预,但这些疗法对患者的临床获益非常有限。近年来批准的几种抗淀粉样蛋白抗体药物,虽然能减少脑内斑块,但在改善认知功能方面的效果仍备受争议。与此同时,越来越多的研究开始关注大脑的代谢稳态,特别是NAD+在神经保护中的作用。NAD+作为细胞能量代谢的关键辅酶,在维持DNA修复、氧化应激防御和线粒体功能中扮演着核心角色。
随着年龄增长,人体内的NAD+水平会自然下降,这种下降在AD患者的大脑中尤为显著。既往研究表明,NAD+的耗竭与神经炎症、血脑屏障(Blood-brain barrier, BBB)破坏以及突触功能障碍密切相关。尽管补充NAD+前体物在部分动物模型中显示出了一定疗效,但传统的补充方式往往会导致NAD+水平过高,从而引发潜在的致癌风险。因此,如何在不产生副作用的前提下,精准恢复大脑的NAD+稳态,成为了AD治疗领域亟待解决的难题。
值得注意的是,临床观察发现,部分携带AD致病突变的人群在发病前可维持数十年的无症状状态,甚至有部分被称为“伴有AD神经病理学的非痴呆个体”(Nondemented with Alzheimer’s neuropathology, NDAN),尽管脑内存在大量淀粉样斑块,却依然能保持正常的认知功能。这一现象暗示了大脑内部存在某种内在的“韧性机制”(Resilience mechanism),能够抵抗病理损伤。研究人员推测,这种韧性可能与大脑维持NAD+稳态的能力直接相关。如果有药物能够激活这种内源性的保护机制,或许就能打破AD不可逆转的魔咒。
为了验证这一假设,研究团队设计了一系列严谨的实验。他们选用了两种经典的AD小鼠模型:以淀粉样蛋白沉积为主的5xFAD小鼠和以Tau蛋白病理为主的PS19小鼠。这两种模型分别模拟了人类AD中两大核心病理特征。研究团队使用了一种名为P7C3-A20的神经保护化合物,该化合物能够激活NAD+补救途径中的限速酶——烟酰胺磷酸核糖转移酶(Nampt),从而在不将NAD+水平推高至生理极限以上的情况下,恢复细胞内的NAD+稳态。
实验结果令人振奋。在5xFAD小鼠模型中,当小鼠已处于AD晚期(6个月龄),表现出明显的认知障碍和病理改变时,每天给予P7C3-A20治疗,持续至12个月龄(共6个月)。结果显示,P7C3-A20不仅恢复了大脑皮层和海马体的NAD+水平,还逆转了包括Tau蛋白磷酸化、血脑屏障渗漏、氧化应激、DNA损伤和神经炎症在内的多种病理特征。更重要的是,治疗组小鼠的海马神经发生(Hippocampal neurogenesis)和突触可塑性得到了显著增强。在Morris水迷宫等行为学测试中,接受治疗的小鼠表现出了与野生型健康小鼠无异的学习记忆能力,实现了认知功能的完全恢复。
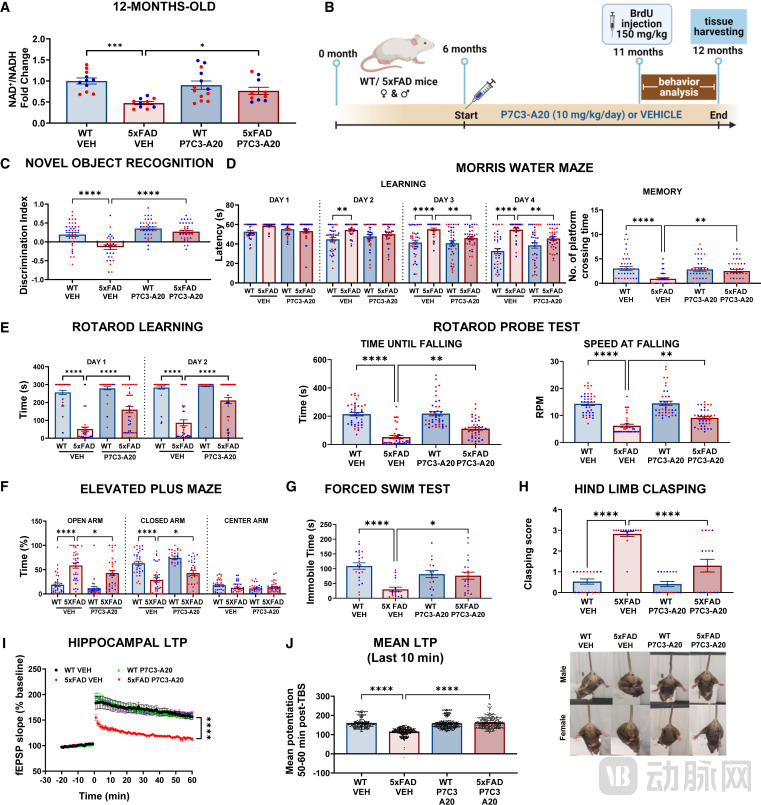
图:P7C3-A20 恢复了老年症状 5xFAD 小鼠的大脑 NAD(+) 稳态、认知功能和突触可塑性
(来源:Cell Reports Medicine)
同样的疗效也在PS19 Tau蛋白病理小鼠模型中得到了验证。在小鼠已进入疾病终末期(11个月龄),通常预期寿命仅剩1个月时开始治疗,P7C3-A20成功逆转了运动功能障碍,并显著减少了脑内的Tau蛋白聚集。此外,研究团队还监测了血液中的生物标志物磷酸化Tau-217(p-tau217)。数据显示,随着治疗的进行,小鼠血浆中的p-tau217水平显著下降,这一结果与目前临床上用于诊断和监测AD患者的生物标志物变化高度一致。Pieper博士对此表示:“在两种由不同遗传原因驱动的动物模型中看到这种效果,加强了恢复大脑NAD+稳态可能帮助阿尔茨海默症患者康复的信心。”
这项研究的意义不仅在于在动物模型中实现了疾病逆转,更在于其揭示了跨越物种的AD共性机制。研究团队通过对比人类AD患者和小鼠模型的脑组织转录组数据,发现NAD+稳态的破坏程度与疾病的严重程度呈正相关。在人类大脑中,尤其是那些尽管有病理改变但未表现出痴呆症状的NDAN个体中,其基因表达谱显示出NAD+稳态得到了较好的保留。这进一步佐证了NAD+稳态是大脑抵御神经退行性病变的关键韧性因素。
通过多组学分析,研究人员还鉴定出了46种在晚期5xFAD小鼠和人类AD大脑中共同发生改变,并能被P7C3-A20治疗所纠正的蛋白质。这些蛋白质涉及突触传递、线粒体代谢和细胞骨架维持等多个关键生物学过程,为未来开发针对人类AD的精准治疗药物提供了潜在的靶点库。与市面上现有的NAD+补充剂不同,P7C3-A20通过调节酶活性来维持平衡,避免了过量NAD+可能带来的肿瘤促进风险,这一点在安全性考量上具有重大优势。
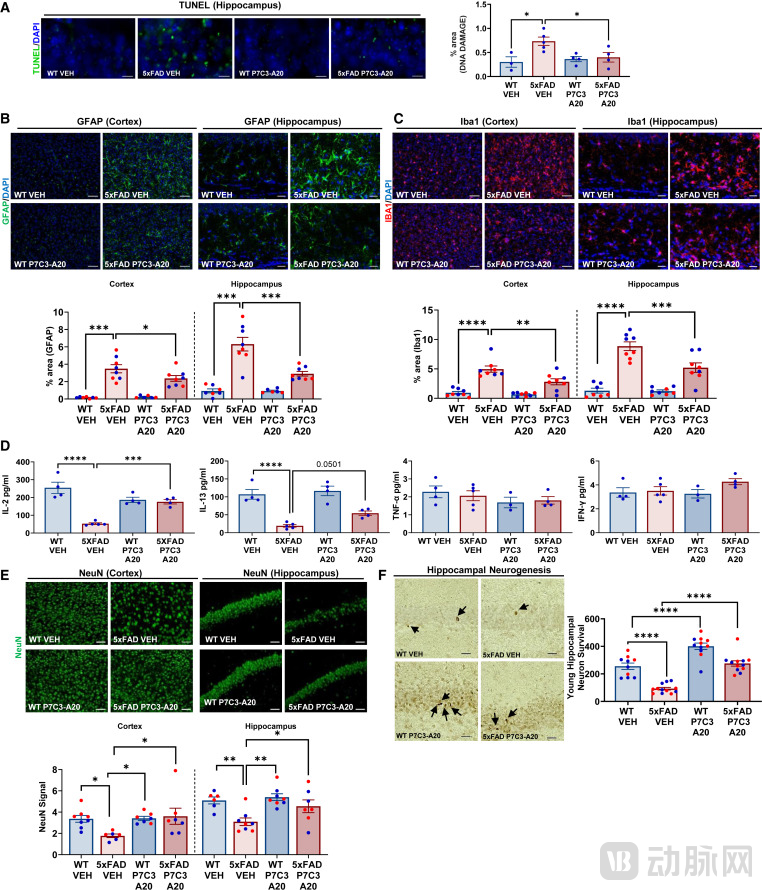
图:P7C3-A20 治疗老年有症状的 5xFAD 小鼠可逆转 DNA 损伤、逆转神经炎症,并防止年轻和成熟神经元细胞死亡
(来源:Cell Reports Medicine)
尽管目前的研究成果主要基于动物模型,但其展示出的“逆转”潜力无疑为AD治疗领域注入了一剂强心针。研究团队正在积极推动这项技术走向临床,由Pieper博士联合创立的Glengary Brain Health公司已着手进行商业化开发。正如Pieper博士所言:“受损的大脑在特定条件下是可以自我修复并恢复功能的。”未来的研究将进一步探索这一疗法在其他年龄相关性神经退行性疾病中的应用潜力,并期待在一期临床试验中验证其在人体内的安全性和有效性。
这项发表于《细胞报告医学》的研究,通过扎实的实验数据挑战了阿尔茨海默症不可逆转的传统观念。它向我们展示了,通过药理学手段精准恢复大脑的NAD+代谢稳态,不仅能阻止疾病进展,更有可能启动大脑的自我修复机制,实现认知功能的复原。这不仅是科学认知上的一次飞跃,更为全球数以亿计的患者及其家庭点亮了重获记忆与尊严的希望之光。




























