人类基因组携带着约2万个基因,但并非所有基因都在所有细胞中表达。表观遗传修饰(Epigenetic modifications)作为基因表达的"调控开关",其失调与几乎所有人类疾病相关。
《自然综述·药物发现》(Nature Reviews Drug Discovery)发表的一篇综述文章指出,表观遗传编辑(Epigenetic editing)技术能够在不改变DNA序列的情况下,精准重写表观遗传标记,实现基因表达的持久调控。
该综述由美国西奈山伊坎医学院Elizabeth A. Heller教授、斯坦福大学Lacramioara Bintu教授以及荷兰格罗宁根大学医学中心Marianne G. Rots教授共同撰写。
文章系统回顾了表观遗传编辑从2003年首次概念验证到2022年首个临床试验启动的发展历程,展示了该技术如何克服早期对效能、特异性和稳定性的质疑,并在动物模型中展现出与CRISPR基因敲除相当的治疗效果。目前,至少14家生物技术公司已投身表观遗传编辑药物研发,已启动三项临床试验,针对肝细胞癌、乙型肝炎和肌营养不良等疾病展开测试。
表观遗传学(Epigenetics)研究的是在DNA序列不变的情况下,如何通过化学修饰调控基因表达。人类基因组中,DNA甲基化(DNA methylation, 5mC)是最经典的表观遗传修饰之一,主要发生在胞嘧啶碱基上,影响基因的转录活性。组蛋白(histones)作为DNA缠绕的"线轴",其翻译后修饰(如乙酰化、甲基化)同样调控着染色质的可及性和基因表达。近年来,大规模多组学计划揭示,许多疾病伴随着全基因组范围的表观遗传变化,这推动了小分子表观遗传药物(epigenetic drugs, epi-drugs)的开发。
目前,FDA已批准10种表观遗传药物,其中9种用于肿瘤治疗,1种用于杜氏肌营养不良症。这些药物通过抑制表观遗传"写入器"(writers)、"擦除器"(erasers)、"阅读器"(readers)或"重塑器"(remodelers)调节基因表达。例如,去甲基化药物阿扎胞苷(azacitidine)和地西他滨(decitabine)用于治疗骨髓增生异常综合征,组蛋白去乙酰化酶抑制剂(HDAC inhibitors)如伏立诺他(vorinostat)用于治疗T细胞淋巴瘤。
然而,这些小分子药物存在显著局限:它们作用于全基因组,缺乏基因特异性,且效果短暂,停药后表观遗传修饰迅速恢复。更重要的是,这种"广谱"作用导致严重的副作用,限制了其在血液系统恶性肿瘤之外的广泛应用。
表观遗传编辑技术提供了全新的解决方案。该技术将可编程的DNA结合域(DNA binding domain, DBD)与表观遗传效应器(epigenetic effectors)融合,实现在特定基因位点精准写入或擦除表观遗传修饰。最早在2003年,研究者将锌指蛋白(zinc finger protein, ZFP)与组蛋白甲基转移酶G9a和Suv39H1融合,成功在VEGFA基因启动子区富集抑制性的H3K9me3修饰,实现了基因沉默。
然而,这一突破性工作在随后十年间鲜有跟进,直到2013年CRISPR-Cas9技术的出现才重新点燃了该领域的热情。失活的Cas9(dCas9)保留DNA结合能力但无核酸酶活性,可通过sgRNA(single guide RNA)精准定位到目标基因,为表观遗传编辑提供了灵活、低成本的平台。这一技术革新使得表观遗传编辑从少数实验室的探索工具,迅速成为学术界和产业界竞相投资的治疗策略。
在表观遗传编辑技术迈向临床的过程中,研究者需要解决四个核心问题:编辑的充分性与效能、位点特异性、对异染色质的可及性,以及诱导编辑的稳定性。这些挑战曾一度被认为是该技术的"不可逾越障碍",但过去十年的研究逐一攻克了这些难题。
编辑的充分性与效能方面,早期研究证实,靶向编辑单一表观遗传修饰足以改变内源基因表达。例如,2013年Maeder等人利用TALE-TET1(TET为DNA去甲基化酶)靶向去甲基化ICAM-1基因启动子,成功激活基因表达;同年Mendenhall等人使用TALE-LSD1(组蛋白去甲基化酶)编辑增强子,实现了基因沉默。
DNA甲基化编辑也显示出因果调控能力:ZFP-DNMT3A(DNA甲基转移酶)能够沉默Her2/Neu等内源基因。然而,编辑效能高度依赖于目标基因、效应器类型和细胞类型。系统性研究发现,低表达基因比高表达基因更易被DNA甲基化沉默;活性转录因子结合位点的甲基化导致基因抑制,而抑制性转录因子结合位点的甲基化反而激活基因表达。这些发现表明,表观遗传编辑的"交战规则"(rules of engagement)极为复杂,需要综合考虑效应器活性、基因组可及性以及内源转录因子和染色质调节因子的招募。
位点特异性是临床应用的关键要求。尽管ZFP和TALE的设计较为复杂,但众多研究已证实其在体内的靶向特异性,包括临床试验中的基因编辑应用。CRISPR-dCas9虽然设计简便,但存在sgRNA-DNA错配导致的脱靶结合问题。研究者通过工程化CRISPR变体、sgRNA化学修饰和脱靶预测算法提高特异性。
值得注意的是,效应器本身也影响特异性:一些效应器如TET1、p300和DNMT3A的全长蛋白会引发全基因组脱靶修饰,甚至导致细胞生长抑制和死亡,这成为构建稳定细胞系的障碍。解决方案包括仅使用催化核心域或理性设计效应器。
令人振奋的是,研究者已实现等位基因特异性编辑(allele-specific editing),即在保持野生型等位基因活性的同时沉默突变等位基因,这为治疗显性致癌基因突变和异常印记模式开辟了道路。
异染色质的可及性曾被视为激活沉默基因的主要障碍。异染色质(heterochromatin)高度压缩,理论上限制表观遗传编辑工具的结合。然而,大量研究表明,人工转录因子(ATFs)和表观遗传编辑器能够成功激活沉默的胎儿基因和肿瘤抑制基因。
虽然异染色质确实影响结合动力学和编辑效率,但并非不可逾越。研究者通过共同靶向转录激活因子或联合使用表观遗传药物,提高了CRISPR-Cas9在沉默位点的活性,这些策略同样适用于提升表观遗传编辑效率。
此外,使用催化域而非全长效应器、采用模块化系统(如SunTag、MS2)以及应用小型DBD(如ZFP或更小的CRISPR变体如Cas12f)都有助于克服尺寸限制,改善对异染色质的可及性。
稳定性是表观遗传编辑相对于基因组编辑的核心优势之一:瞬时表达编辑器即可实现持久的基因调控,效果堪比CRISPR敲除,但避免了永久性基因组改变的风险。然而,预测哪些表观遗传编辑能够在编辑器移除后维持仍是挑战。
研究表明,启动子靶向的DNA甲基化在某些基因(如SOX2、CDKN2A)可实现持久沉默,但在其他基因(如VEGFA)则无法维持。全基因组研究发现,约25%的靶点在编辑1周后仍保持DNA甲基化,维持性与抑制性H3K27me3的基础富集相关,提示DNA甲基化与组蛋白修饰的协同作用对稳定性至关重要。
事实上,组合型编辑器显著提升了维持效果。2016年Amabile等人的开创性研究显示,KRAB与DNMT3A3L的组合靶向B2M、IFNAR1和VEGFA基因,实现了协同维持效应。
2021年,Nuñez等人开发的CRISPRoff(KRAB-dCas9-DNMT3A3L融合蛋白)进行了首次全基因组筛选,证实许多基因的瞬时沉默可长期维持。
2024年的里程碑研究表明,单次静脉注射LNP递送的ZFP-KRAB-DNMT3A3L mRNA靶向沉默小鼠Pcsk9基因,降胆固醇效果持续至少1年,且在肝脏再生后仍维持效果超过2个月,效率与传统基因敲除相当。
表观遗传编辑在动物模型中的成功应用为其临床转化奠定了坚实基础。综述将体内研究分为四类:I类为转基因表达编辑器的动物模型,II类为早期胚胎瞬时表达后产生的动物,III类为体外重编程细胞的移植研究,IV类为直接体内给药的疾病模型。
神经精神疾病是表观遗传编辑最早的应用领域之一。2014年,Heller等人利用ZFP-G9a靶向小鼠脑内Fosb基因写入抑制性H3K9me3,成功阻断可卡因诱导的Fosb表达和奖赏行为,同时降低小鼠攻击性。随后研究扩展至創伤后应激障碍(PTSD)、酒精使用障碍等疾病模型。
特别值得关注的是,2022年Bohnsack等人使用dCas9-p300靶向Arc基因的SARE增强子,增加H3K27Ac修饰,成功改善青春期酒精暴露后的成年焦虑和过度饮酒行为。这些研究不仅验证了特定基因的表观遗传调控与疾病表型的因果关系,也展示了表观遗传编辑介入复杂精神疾病的潜力。
神经退行性疾病是另一重要靶向领域。针对阿尔茨海默病,研究者利用dCas9-TET1去甲基化Cathepsin D基因,促进淀粉样蛋白-β降解;或用dCas9-DNMT3A沉默APP基因(编码淀粉样蛋白前体蛋白),减少病理蛋白产生。
2024年,Han等人开发了光诱导外泌体递送dCas9-DNMT3A核糖核蛋白复合物(RNP),经鼻腔给药靶向Bace1基因(编码β-分泌酶1),减轻淀粉样蛋白病理并改善识别记忆缺陷。
在帕金森病模型中,靶脑外泌体递送dCas9-DNMT3A沉默SNCA基因(编码α-突触核蛋白),缓解了疾病样损害。脆性X综合征(FXS)的研究尤为令人鼓舞:FMR1基因因重复序列扩增而形成异染色质并转录沉默,Liu等人利用dCas9-TET1去甲基化FMR1,成功激活基因表达并挽救FXS小鼠模型的表型,激活效果在移植后的神经元中维持长达3个月。这一研究不仅证明表观遗传编辑能够激活深度沉默的异染色质基因,还提示其在有丝分裂后神经元中的持久性。
肿瘤学领域的研究主要集中于III类(细胞移植)研究。多项研究通过稳定表达ZFP-DNMT3A或TALE-TET1编辑肿瘤细胞,再移植至动物体内,证实靶向沉默或激活单一癌症相关基因(如SOX2、MGMT、Par4、Dpp4)可降低肿瘤侵袭性。
2025年,Lin等人使用CRISPRoff瞬时沉默MGMT基因(编码O6-甲基鸟嘌呤-DNA甲基转移酶),使原发性胶质母细胞瘤细胞对替莫唑胺化疗增敏,沉默效果在移植后至少维持10天。这些研究提示,即使是瞬时的表观遗传编辑,也可能增强现有疗法的疗效。
肝脏疾病成为最具临床转化前景的领域。2024年的两项独立研究分别报道了靶向Pcsk9基因实现长期降胆固醇的成果:Cappelluti等人使用ZFP-KRAB-DNMT3A3L mRNA封装于LNP中,单次静脉注射小鼠后,Pcsk9沉默和胆固醇降低效果持续至少1年,且在强制肝脏再生后仍维持2个月以上;O'Donnell等人使用TALE-MQ1(细菌DNA甲基转移酶)同样实现了长达6个月的Pcsk9沉默。
更重要的是,后续的人源化转基因小鼠和灵长类动物研究验证了效能和持久性,并证实可通过靶向TET1实现沉默的可逆性,PCSK9表达恢复效果在体内至少维持42天。这些数据为表观遗传编辑的临床应用提供了强有力的证据。
在递送技术方面,腺相关病毒(AAV)和脂质纳米颗粒(LNP)是两大主流平台。AAV是临床试验中CRISPR工具最常用的递送方式,但严重不良事件(包括死亡病例)提示病毒衣壳可能引发免疫毒性。AAV的4.7 kb载荷限制也限制了大型表观遗传编辑器的应用,研究者通过开发双AAV系统、使用更小的Cas变体(如Cas12f)或招募内源效应器的策略(如ZFP融合H3K4me0和DNMT3L招募内源DNA甲基转移酶)来克服这一障碍。LNP作为SARS-CoV-2 mRNA疫苗的成功载体,已在表观遗传编辑中展现应用潜力,其低免疫原性允许重复给药,且可通过靶向配体实现组织特异性递送。
此外,非病毒递送方法(如工程化细胞、支架、病毒样颗粒和重组蛋白)也在探索中。2025年,Yano等人首次报道了无载体气道内递送ZFP或dCas9融合TET1和TDG(胸腺嘧啶DNA糖基化酶)重组蛋白,通过雾化吸入和鼻内溶液靶向小鼠肺上皮细胞Cxcl11基因,实现去甲基化和基因激活,使小鼠对干扰素-γ产生反应性。
临床转化的步伐正在加速。至少14家公司已投身表观遗传编辑药物开发,多数采用靶向DNA甲基化或去甲基化策略。2022年,Omega Therapeutics公司的OTX-2002成为首个进入临床试验的表观遗传编辑药物,该疗法利用ZFP-MQ1和ZFP-KRAB组合沉默MYC癌基因,针对肝细胞癌等实体瘤,已获FDA孤儿药资格,但I/II期MYCHELANGELO I研究(纳入24例患者)未能继续推进。
Tune Therapeutics的Tune-401已在西太平洋地区启动临床试验,采用CRISPR介导的DNA甲基化沉默乙型肝炎病毒基因(包括整合和游离闭合环状DNA)。2025年,Epicrispr的EPI-321获FDA孤儿药资格并完成首例患者治疗,该疗法使用dCasMINI(dCas12f)恢复面肩肱型肌营养不良症(FSHD)患者DUX4基因的DNA甲基化,其小尺寸使得AAV递送成为可能。其他临床管线靶向阿尔茨海默病(APOEe4)、杜氏肌营养不良症(UTRN)、肌萎缩侧索硬化症(C9orf72)、亨廷顿病(HTT)、帕金森病(SNCA)等疾病。
表观遗传编辑技术在短短二十年间从概念验证发展至临床试验,展现了其作为新型治疗策略的巨大潜力。与永久性基因组编辑相比,表观遗传编辑提供了"精准、可逆、持久"的独特优势。研究已证实,该技术能够实现与CRISPR敲除相当的治疗效果,同时避免了DNA双链断裂可能导致的染色体易位和其他基因组异常。更重要的是,表观遗传编辑的可逆性为临床应用提供了安全保障:灵长类动物研究已证实,靶向TET1可恢复被沉默基因的表达,且恢复效果可维持至少42天。
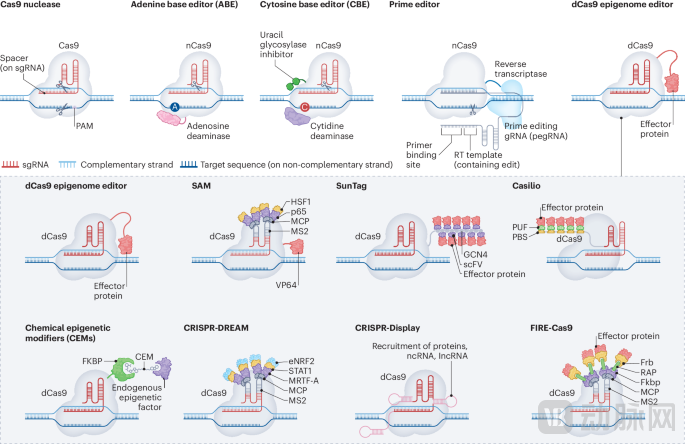
图:发现与医学中的表观基因组编辑技术
(来源:Nature)
然而,该技术仍面临挑战。预测特定表观遗传编辑在给定基因和细胞类型中的效能和稳定性仍缺乏简明规则。目前的"交战规则"包括:效应器域活性、基因组位点可及性、内源转录因子和染色质调节因子的招募、CpG密度、核小体定位以及可变转录起始位点的使用等多重因素。
高通量筛选和系统性研究正在填补这一知识空白,但个体化预测仍需进一步发展。此外,递送技术的优化、生物标志物的开发以及对表观遗传重编程机制的深入理解,都是实现广泛临床应用的关键。
从伦理角度看,表观遗传编辑相较于基因组编辑被认为侵入性更低且更易逆转,但两者都对人类健康和进化构成潜在风险。由于胚胎发生期间的擦除波和表观遗传重编程,表观遗传编辑的跨代遗传可能性远低于基因组编辑。尽管小鼠研究显示基因靶向甲基化及相关表型可跨代遗传,但这可能与实验诱导的DNA"疤痕"相关。严格、负责任的技术创新将确保这一强大且多用途的新型治疗方法的安全应用。
展望未来,表观遗传编辑有望成为精准医学的重要组成部分。随着ZFP、TALE和CRISPR等平台的持续优化,以及LNP、AAV和其他递送系统的改进,该技术将为更多疾病提供治疗选择。
正在进行的临床试验将提供关键的疗效和安全性数据,为后续药物开发指明方向。表观遗传编辑不仅是一种研究工具,更是即将改变临床实践的治疗策略。从"广谱药物"到"精准编辑",从"概念验证"到"临床应用",这一技术的每一步跃进都在重塑我们对基因调控和疾病治疗的理解,为无数患者带来新的希望。




























