全球MCE领域累计交易金额已超90亿美元(2022-2025),诺华、礼来、安斯泰来等巨头纷纷通过合作入局。
2025年更是迎来爆发。3月,赛诺菲以最高19亿美元收购Dren Bio附属公司,将核心髓系细胞衔接器(MCE)药物DR-0201收入囊中;12月再续前缘,达成扩展合作,聚焦下一代自身免疫疾病领域的多特异性MCE疗法开发。7月,葛兰素史克(GSK)与中国泽安生物达成超15亿美元合作,拿下4款MCE肿瘤新药全球权益。
与巨头狂热形成鲜明对比的是,全球明确布局MCE的Biotech仅个位数,核心技术型企业不足5家。这一“冰火两重天”,抛出了行业两大核心疑问:为何在技术尚处早期阶段,大药企就急于“抢滩”?为何MCE前景被普遍看好,却鲜有Biotech入局?
免疫治疗进入瓶颈期,髓系细胞疗法走到台前
自2013年免疫检查点抑制剂获批以来,T细胞导向的免疫治疗一度成为肿瘤研发的绝对主线。但历经十余年临床实践,其在实体瘤中的疗效边界正逐步显现。
美国临床肿瘤学会(ASCO)2024年公布的多项临床试验数据显示,PD-1/PD-L1抑制剂单药治疗多数实体瘤时,客观缓解率(ORR)普遍不足25%[1]。即便是CAR-T、T细胞衔接器(T-cell Engager,TCE)等后续技术迭代产品,在实体瘤中同样受到疗效限制。
这并非个例的产品或靶点问题,而是T细胞路线面临结构性障碍。研究指出,抗原异质性、肿瘤微环境抑制、T细胞渗透与持久性不足,导致T细胞相关疗法难在实体瘤领域复制血液瘤的成功[2]。
更深层的瓶颈,来自肿瘤微环境(Tumor Microenvironment,TME)本身。实体瘤致密的基质结构与免疫抑制信号网络,使T细胞即便成功进入肿瘤组织,也难以维持持续有效的杀伤作用。
更关键的是,T细胞并非实体瘤免疫生态中的“数量主力”。在胰腺癌、三阴乳腺癌等典型冷肿瘤中,巨噬细胞、树突状细胞等髓系细胞往往构成最主要的免疫细胞群体,对局部免疫微环境的走向起到关键调控作用[3][4]。这一认识,促使髓系细胞的治疗潜力重新回到行业视野。
已有研究证实,在特定激活条件下,人类巨噬细胞不仅能够清除凋亡细胞,还可被诱导吞噬活肿瘤细胞,实现主动抗肿瘤效应[5];同时,髓系细胞天然具备“浸润—驻留—抗原呈递”的生物学特性,使其能够在 T 细胞疗法渗透或持续作用受限的肿瘤场景中,补齐其在递送与微环境调控层面的不足,并与现有免疫疗法形成机制互补。
在此背景下,先天免疫,尤其是髓系免疫,逐渐成为跨国药企的重要布局方向。随着PD-1/PD-L1疗效进入边际改善阶段,T细胞疗法的增量空间逐渐收窄,行业共识正在形成:下一阶段免疫治疗的突破,或将来自对髓系细胞的精准调控。
过去的很长时间里,这一方向停留在基础研究层面。近年来,随着双特异抗体工程、结构优化与递送策略的成熟,髓系免疫首次被系统性地工程化为可给药的衔接器分子。随着多家创新企业完成早期验证并获得MNC背书,MCE也由此从机制探索,逐步迈入产业化验证阶段。
多学科交叉、高难度的新型衔接器
回到其技术原理本身,MCE并不只是把T细胞换成巨噬细胞那么简单,而是一个技术、工程、免疫、生物学多重交叉、难度极高的新领域。
所谓“衔接器(Engager)”,本质是一类通过工程化分子设计,将两种原本难以直接协同的细胞或信号通路强制拉到同一空间尺度内的治疗策略。在免疫治疗领域,最为人熟知的是TCE,通过同时结合肿瘤抗原与CD3分子,诱导T细胞对肿瘤细胞的定向杀伤;此外,还出现过NK细胞衔接器(NK Engager)等变体。但无论是哪一类,其核心思想都是:用分子工程弥补免疫系统在空间和效率上的天然不足。
MCE正是在这一逻辑下诞生的延伸路径,只不过其被动员的对象不再是T细胞,而是数量更为庞大、却长期被忽视的髓系细胞群体。
MCE的核心机制,是利用双特异性抗体实现“桥接”作用:一端识别肿瘤或病理细胞表面的特异性抗原(如CD20、CD79b、PD-L1),另一端结合髓系细胞上的关键受体(如Dectin-1、CLEC5A、SIRPα),从而在局部TME中拉近两类细胞的物理距离,并将原本“被抑制”的髓系细胞重新导向吞噬与清除功能。
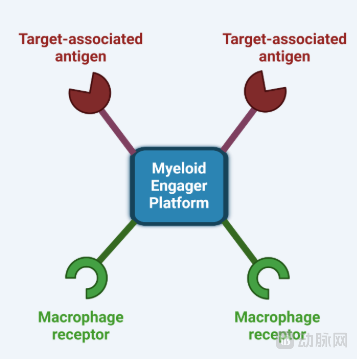
泽安生物MCE平台示意图
这一机制在概念上与TCE相似,但面向的却是完全不同的免疫系统。髓系细胞在许多实体瘤中处于被肿瘤“驯化”的状态,常表现为促肿瘤的M2型巨噬细胞[6]。如果不能在“精准识别”与“有效激活”之间维持微妙平衡,MCE不仅难以产生治疗效果,甚至可能引发炎症风暴或误伤正常细胞。因此,看似只是“换了对象”的双抗工程,背后却是难以跨越的技术壁垒,使得这一赛道天然呈现出高门槛、少玩家的格局。
三类玩家生态位正在形成
尽管玩家稀少,相对清晰的三层结构已经呈现:由核心技术型企业定义技术上限,国际巨头通过合作加速扩散,而具备免疫工程基础的公司则处于随时可能切入的待启阶段。
1核心技术派玩家Biotech
作为赛道奠基者,Biotech掌握MCE专有技术平台,是巨头合作/收购的核心对象。在全球MCE赛道中,真正拥有从靶点选择到分子工程,再到功能验证能力的公司屈指可数。
以下四家公司通过不同靶点和策略,探索髓系免疫再造—从经典“解除抑制+吞噬”到“多机制杀伤+Fc优化/双表位设计”,构成了当前的MCE技术图谱。
按照核心技术分类,可分为三条主流路径:
Dren Bio是最早系统推进MCE的公司之一,其特色在于将髓系受体Dectin-1作为激活开关,通过Dectin-1×抗原的双特异抗体让巨噬细胞等髓系细胞恢复吞噬活性。这一路径绕开T细胞依赖,理论上可用于肿瘤、异常细胞或自身免疫性疾病。
DR-0201(CD20靶向)作为潜在同类首创MCE药物,通过靶向吞噬诱导B细胞深度耗竭,目前在多个I期研究中评估深度B细胞耗竭的安全性与潜力,涵盖B细胞非霍奇金淋巴瘤与B细胞介导的自身免疫疾病等适应症;实体瘤方向的DR-0202也已进入Ⅰ期临床阶段。
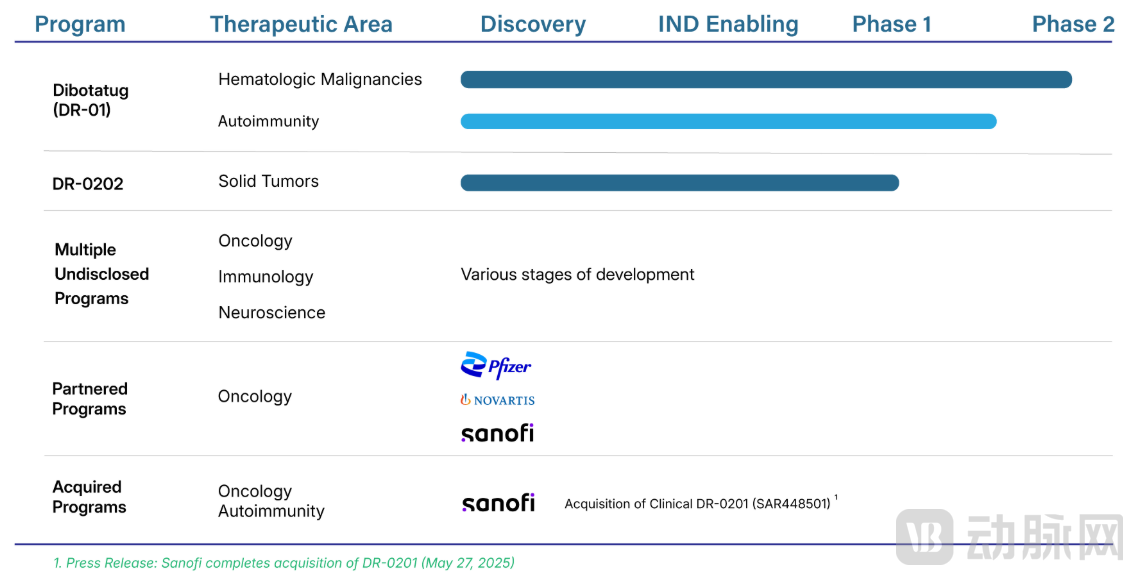
Dren Bio管线进展
在商业化与战略合作方面,Dren Bio吸引了赛诺菲、辉瑞、诺华的关注,迅速成为MCE赛道中不可忽视的重要玩家。
泽安生物是中国MCE赛道的核心创新者,以髓系细胞特异性受体CLEC5A为核心靶点,构建了自主研发的髓系细胞衔接器技术平台Myeloid Engager。其技术亮点在于结合Fc段工程优化,形成“髓系细胞+NK细胞”双通路激活策略,在激活髓系吞噬功能的同时,仅释放极少促炎细胞因子,兼顾疗效与安全性。
公司定位肿瘤与自免双领域,首款候选药物LTZ-301(CD79b×CLEC5A双抗)已获FDA批准IND,用于治疗复发/难治性非霍奇金淋巴瘤;实体瘤管线TZ-232(EpCAM靶向)针对实体瘤及恶性腹水,目前处于IND-enabling阶段。如开头所述,泽安生物同样也获得了MCN的青睐。2025年7月,葛兰素史克(GSK)与其达成总额超15亿美元的合作协议,获得4款MCE肿瘤新药的全球开发与商业化权益,同时推动创新MCE疗法在实体瘤和血液瘤中的应用。
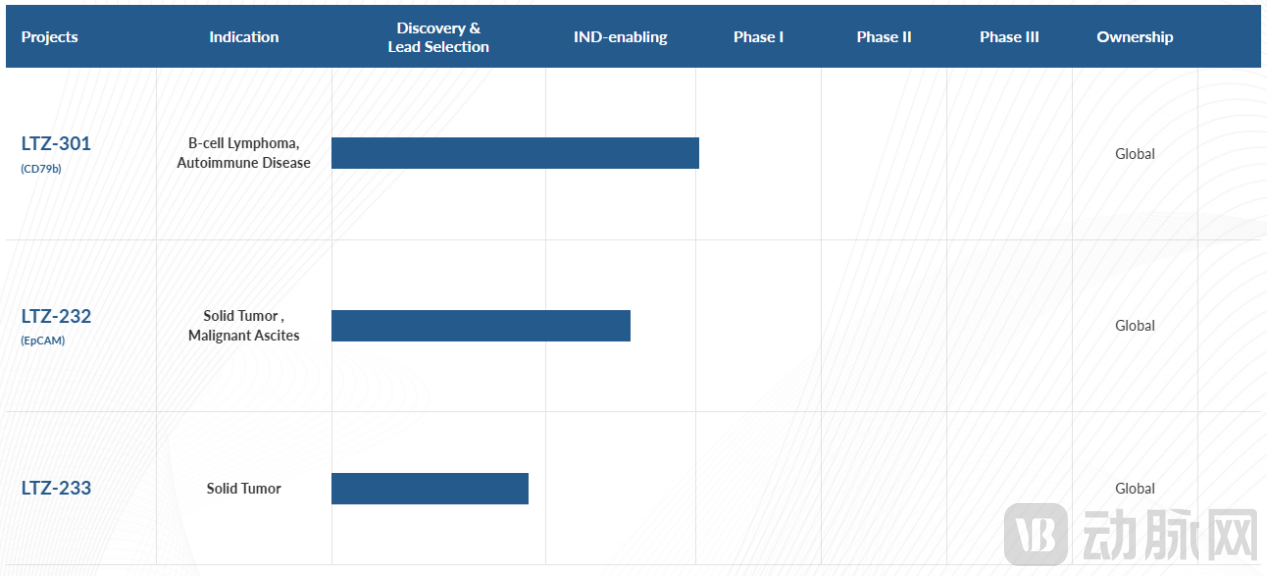
泽安生物管线进展
科望医药(Elpiscience)的BiME®平台从经典的CD47–SIRPα“别吃我(don’t-eat-me)”抑制通路切入,通过工程化SIRPα结构并引入双特异增强设计,在解除肿瘤对髓系吞噬抑制的同时放大吞噬信号,推动治疗机制由单纯免疫解除向“主动清除+吞噬增强”升级。
管线覆盖肿瘤与自身免疫两大方向:核心产品ES019(SIRPα/PD-L1 双特异抗体)已授权给安斯泰来,用于肿瘤领域的全球开发;在自身免疫方向,BiME B Cell Depletion系列旨在通过激活巨噬细胞介导的深度B细胞清除,探索在难治性自身免疫疾病中的治疗潜力。

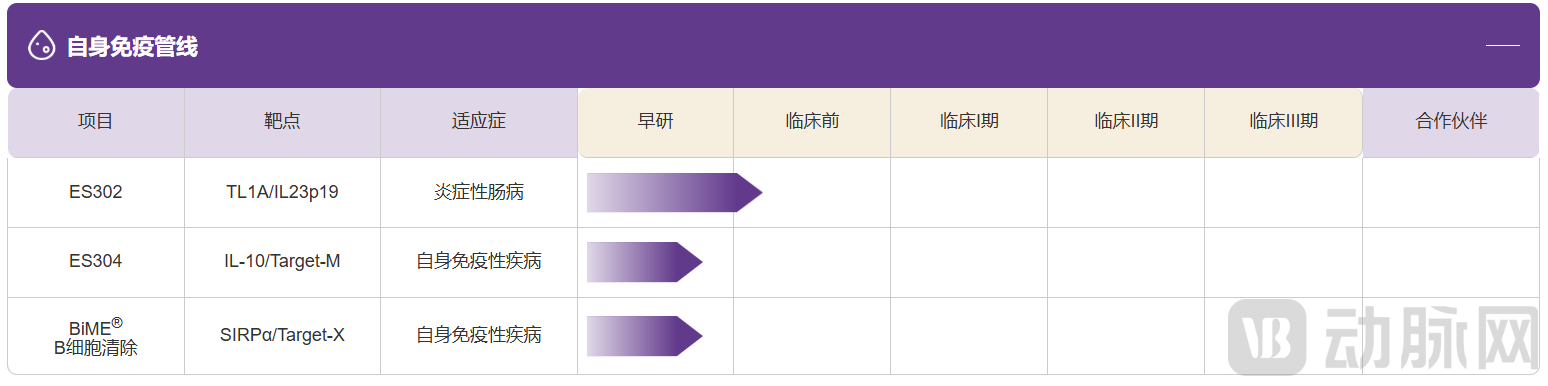
科望医药管线进展
Glenmark旗下IGI所开发的ISB 1442在官网明确分类为“Myeloid-Cell Engager (MCE)”的候选药物。它采用biparatopic CD38 CD47双特异/双表位(bispecific,biparatopic)抗体结构:两条针对CD38 的Fab臂分别结合不同表位,同时另一臂阻断CD47–SIRPα信号,再加上Fc端工程优化,同时诱导抗体依赖性吞噬(ADCP)、细胞毒性(ADCC)与补体毒性(CDC)等多重效应。
目前,该分子正处于I/II期临床,用于复发/难治性多发性骨髓瘤(MM),公司同时规划扩展至急性髓系白血病(AML)等血液肿瘤领域。

ISB 1442管线进展
2MNC玩家通过大额交易入局
MNC通过高额交易收购管线资产或技术平台,快速抢占赛道。
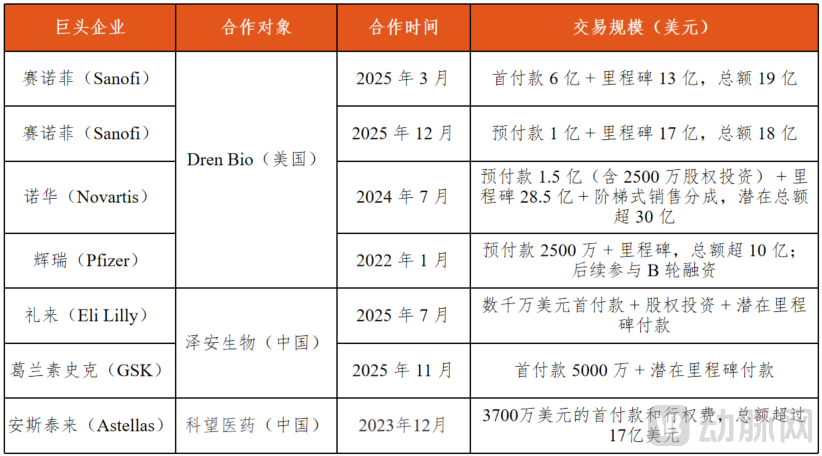
2023年-2025年MCE相关合作汇总
诺华2024年以30亿美元打包引进Dren Bio多款MCE管线;赛诺菲收购DR-0201则瞄准自免市场,试图冲击利妥昔单抗的超十亿美元市场份额;GSK将MCE纳入“ADC+IO Engager”复合战略,聚焦实体瘤领域的未满足需求。
巨头的入局逻辑高度一致,通过绑定关键Biotech,获取技术平台与管线资产,以弥补自身管线在先天免疫领域的短板。其动机非常明确:当T细胞路径进入瓶颈,他们需要下一代免疫治疗的底层能力,而MCE正是极少数具有潜力的重塑实体瘤免疫策略。
3免疫疗法大药企成为潜在观望派
虽无明确MCE管线,但有类企业具备技术储备,伺机入局。吉利德曾布局CD47靶点,虽因安全性问题暂停部分项目,但其已有的靶点技术与MCE研发高度相关,可为双抗设计提供基础;宜明昂科的IMM0306通过调控髓系细胞通路治疗自免疾病,其作用逻辑与MCE相似,技术可扩展至肿瘤或其他适应症;信达生物深耕CD47-SIRPα通路,技术可直接复用至MCE双抗开发。
总体来看,随着髓系细胞靶向技术的逐步成熟,以及更多早期临床数据的释放,这些企业极可能通过已有靶点平台、管线拓展或双抗技术复用,成为下一批进入MCE赛道的玩家。
判断MCE前景,核心在于临床突破
要判断MCE能否成为下一代免疫治疗的重要方向,仍需在更多临床数据与真实世界验证的基础上,从未满足需求、机制差异化及工程与安全挑战等多个维度持续观察与评估。
需求端,肿瘤与自免两大核心领域的庞大市场规模,为MCE提供了广阔的落地空间。从实体瘤领域来看,据Wiseguy Reports数据,2024年全球实体瘤治疗市场规模已达1811.3亿美元,预计2032年将增长至2720.6亿美元(CAGR5.22%)。自免疾病市场同样潜力可观,据Frost&Sullivan数据,2022年全球自免市场规模达1323亿美元,预计2030年将增长至1767亿美元(CAGR3.68%)。
其次,与现有路径相比,MCE的差异化优势也较为突出。
传统髓系疗法如CD47阻断剂往往带来贫血、血小板减少等不良反应,代谢重编程策略起效缓慢、且在临床中可控性有限;相比之下,MCE通过精准锁定髓系细胞受体(如CLEC7A、CD206/209等),能在肿瘤区域实现更高的药效集中度与更佳的安全窗口。
与TCE相比,MCE在实体瘤渗透能力更强,细胞因子释放综合征(CRS)风险更低,因此与TCE等T细胞疗法也能形成互补策略。诺华生物医学研究肿瘤学负责人Shiva Malek曾表示,MCE可与诺华现有CAR-T疗法形成互补,覆盖更多肿瘤患者
但挑战同样不容忽视。技术层面,长期安全性验证、髓系细胞功能调控等仍需突破;产业层面,双抗生产工艺复杂,规模化生产的稳定性控制是中小企业的重要障碍。更关键的是,目前全球MCE均处于1期临床或临床前阶段,暂无成熟产品上市,临床数据不足可能影响资本信心。
未来的发展路径逐渐明朗。短期看临床读出,DR-0201、LTZ-301等产品的安全性和疗效将成为行业的压力测试;中期,MCE与ADC、PD-1、CAR-T等联合策略预计会成为突破点;长期,在机制深入理解后,其应用有望从肿瘤延伸至自免、感染等更广泛的免疫调控场景。
整体来看,MCE具备被寄予厚望的三大基础逻辑:它直击实体瘤免疫失败的核心矛盾(髓系抑制)、与当前免疫疗法形成天然机制互补、多企业管线临床前结果呈现一致性。但其高门槛也意味着:没有临床数据的真正“亮相”,行业无法得出最终判断。
MCE此刻处在一个关键拐点——需求明确、科学逻辑扎实,但未来能走多远,将由接下来3–5年内的临床读出决定。如果技术难题能够被逐步攻克,MCE有望成为下一代免疫治疗的核心赛道。
参考资料:
[1]Joel Neal et al. CONTACT-01: A Randomized Phase III Trial of Atezolizumab + Cabozantinib Versus Docetaxel for Metastatic Non–Small Cell Lung Cancer After a Checkpoint Inhibitor and Chemotherapy. J Clin Oncol 42, 2393-2403(2024).
[2]Vo MC, Tran VD, Nguyen VT, Ruzimurodov N, Trung DT, Kim SK, Jung SH, Lee JJ. Challenges and limitations of chimeric antigen receptor T-cell therapies in solid tumors: why are approvals restricted to hematologic malignancies? J Hematol Oncol. 2025 Oct 27;18(1):91. doi: 10.1186/s13045-025-01744-9. PMID: 41146230; PMCID: PMC12557894.
[3]Vazquez I, Dar TB, Stevens S, Viramontes J, Canseco E, Ko E, et al. 519 Targeting myeloid inflammation to reprogram the immunosuppressive microenvironment of triple-negative breast cancer. Journal for ImmunoTherapy of Cancer. 2024;12:. https://doi.org/10.1136/jitc-2024-SITC2024.0519
[4]秦雅含,张珂,张梦雨,等.MDSC靶向免疫治疗胰腺癌的研究进展[J].上海交通大学学报(医学版), 2023, 43(10):1317-1323.
[5]Samantha Y Liu, Max P M Hulsman, Philipp Leyendecker, Eugena Chang, Katherine A Donovan, Fabian Strobel, James Dougan, Eric S Fischer, Michael Dougan, Stephanie K Dougan, Li Qiang, SMAC mimetics induce human macrophages to phagocytose live cancer cells, Immunotherapy Advances, Volume 5, Issue 1, 2025, ltaf026, https://doi.org/10.1093/immadv/ltaf026
[6]Ge W, Wu W. [Influencing Factors and Significance of Tumor-associated Macrophage Polarization in Tumor Microenvironment]. Zhongguo Fei Ai Za Zhi. 2023 Mar 20;26(3):228-237. Chinese. doi: 10.3779/j.issn.1009-3419.2023.106.07. PMID: 37035885; PMCID: PMC10106802.




























