随着老视(俗称“老花眼”)患者对非侵入性视力改善方案需求的持续增长,药物性瞳孔调节逐渐成为该领域的重要研发方向。Tenpoint Therapeutics近日宣布,美国FDA已批准Yuvezzi(carbachol和brimonidine tartrate滴眼液,2.75%/0.1%),用于治疗成人老花眼,成为该公司在老视治疗领域的首个商业化产品。根据新闻稿,Yuvezzi是首款获FDA批准用于治疗老花眼的双药复方滴眼液。Yuvezzi采用每日一次给药方案,可在用药30分钟后产生缩瞳作用并持续10小时,从而改善近视力。
老花眼是因老化而逐渐丧失近距离视力,以致难以执行阅读小字体等工作的眼病。老花症状通常在40岁人群中开始出现,在50岁人群中几乎成为常态。老花眼影响全球数十亿人,中国、南韩及东南亚患者数目约达6亿,亚太地区目前并无认可的老花眼矫正疗法。事实上,矫正近距离视力最常见的方法是佩戴阅读眼镜。然而,许多人认为佩戴眼镜造成不便,或因不美观而选择不佩戴眼镜。
“双药复方”,1+1>2的“针孔效应”
Yuvezzi是一款固定剂量复方滴眼液,由两种作用机制互补的活性成分组成:卡巴胆碱(carbachol)和酒石酸溴莫尼定(brimonidine tartrate)。该产品为等渗、无菌、澄清的黄绿色溶液,采用单剂量滴眼设计,用于眼局部给药。

Yuvezzi主要亮点介绍,包含给药频次、药效时间等
其中,卡巴胆碱化学名为2-氨甲酰氧乙基(三甲基)氯化铵。分子量为182.65 g/mol,分子式为C₆H₁₅ClN₂O₂。分子结构如下:
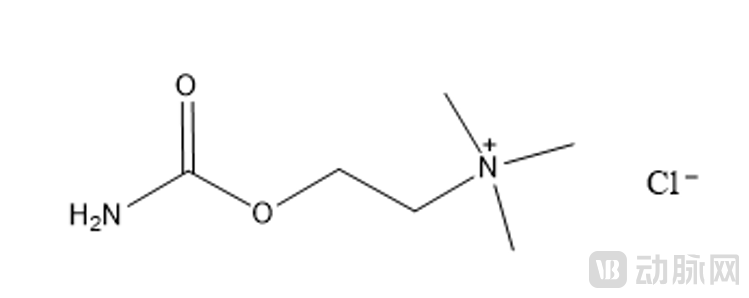
酒石酸溴莫尼定化学名为5-溴-N-(4,5-二氢-1H-咪唑-2-基)-6-喹喔啉胺L-酒石酸盐。分子量为442.226 g/mol,分子式为C₁₅H₁₆BrN₅O₆。分子结构如下:
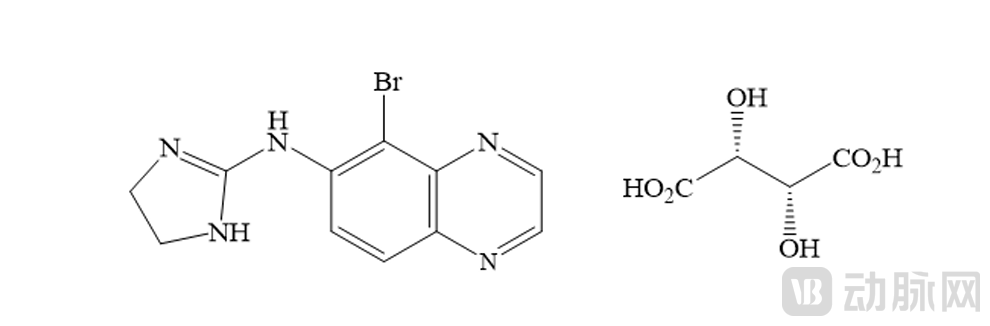
从药理学角度看,Yuvezzi的治疗理念并非通过改变晶状体屈光力,而是通过可控的瞳孔收缩产生“针孔效应”,从而提高近距离视敏度并增加景深。这一策略在老视治疗中被认为能够在改善近视力的同时,最大限度降低对远视力的影响。
在这一机制中,卡巴胆碱作为胆碱能受体激动剂,可直接诱导虹膜括约肌和睫状肌收缩,促使瞳孔缩小;酒石酸溴莫尼定则是一种α-肾上腺素能受体激动剂,通过抑制虹膜开大肌收缩并调节睫状肌张力,增强瞳孔收缩的选择性和稳定性。两种成分协同作用,使瞳孔缩小更加平衡、持久,也有助于延长卡巴胆碱在前房中的作用时间。
在制剂层面,每毫升Yuvezzi含卡巴胆碱2.75%(27.5 mg/mL)和酒石酸溴莫尼定0.1%(1 mg/mL)。制剂中还包含羟丙甲纤维素(HPMC)以改善滴眼液在眼表的滞留性,并使用磷酸盐缓冲体系维持溶液稳定性,必要时通过盐酸或氢氧化钠调节pH值。
安全性+疗效+耐受性+作用时长,四维度兼顾
Yuvezzi的药效学特征在多项III期临床研究中得到了系统评估。研究人员采用自动化数字瞳孔测量技术,在暗视条件下对给药前后瞳孔变化进行量化分析。在BRIO I研究中,YUVEZZI在给药后0.5小时起至10小时内,平均瞳孔直径缩小幅度均显著优于两种活性单药;在 BRIO II研究中,Yuvezzi在给药后0.5至8小时内的瞳孔缩小效果亦显著优于溶媒对照,显示出稳定且持续的药效特征。
在全身暴露方面,Yuvezzi显示出较低的系统吸收水平。在老视受试者中,单次双眼各滴1滴后,仅少数受试者可检测到可量化的血浆药物浓度。溴莫尼定的峰浓度最高为0.066 ng/mL,达峰时间约为0.52小时;卡巴胆碱的峰浓度最高为1.02 ng/mL,达峰时间约为4.42小时,提示该复方制剂主要发挥局部作用。
已有研究显示,溴莫尼定在血浆中的蛋白结合率约为29%,并在体内经肝脏广泛代谢,其代谢产物主要通过尿液排泄。相比之下,卡巴胆碱的系统代谢与排泄特征尚未在人体中进行系统研究,但现有数据并未提示明显的全身安全性风险。
在非临床安全性方面,两种活性成分在体内外研究中均未显示致突变性或致染色体损伤作用。酒石酸溴莫尼定在大鼠生殖和生育力研究中,口服剂量高达1 mg/kg时,未观察到对雌雄生育力的不良影响。Yuvezzi及卡巴胆碱尚未开展专门的生育力或致癌性研究。
Yuvezzi的临床疗效主要基于两项III期、随机、双盲、对照研究。BRIO I(NCT05270863)采用交叉设计,共纳入182名45-80岁老视患者,评估单次给药效果;BRIO II(NCT05135286)为平行对照研究,共纳入358名受试者。
结果显示,在给药后30分钟至8小时内,Yuvezzi组中,在暗视条件下双眼未矫正近视力(BUCNVA)较基线改善≥3行(≥15个字母),且未出现双眼未矫正远视力(BUCDVA)下降≥1行(≥5个字母)的受试者比例显著高于溶媒对照组(p<0.01),支持其在改善近视力同时维持远视力稳定性的临床价值。
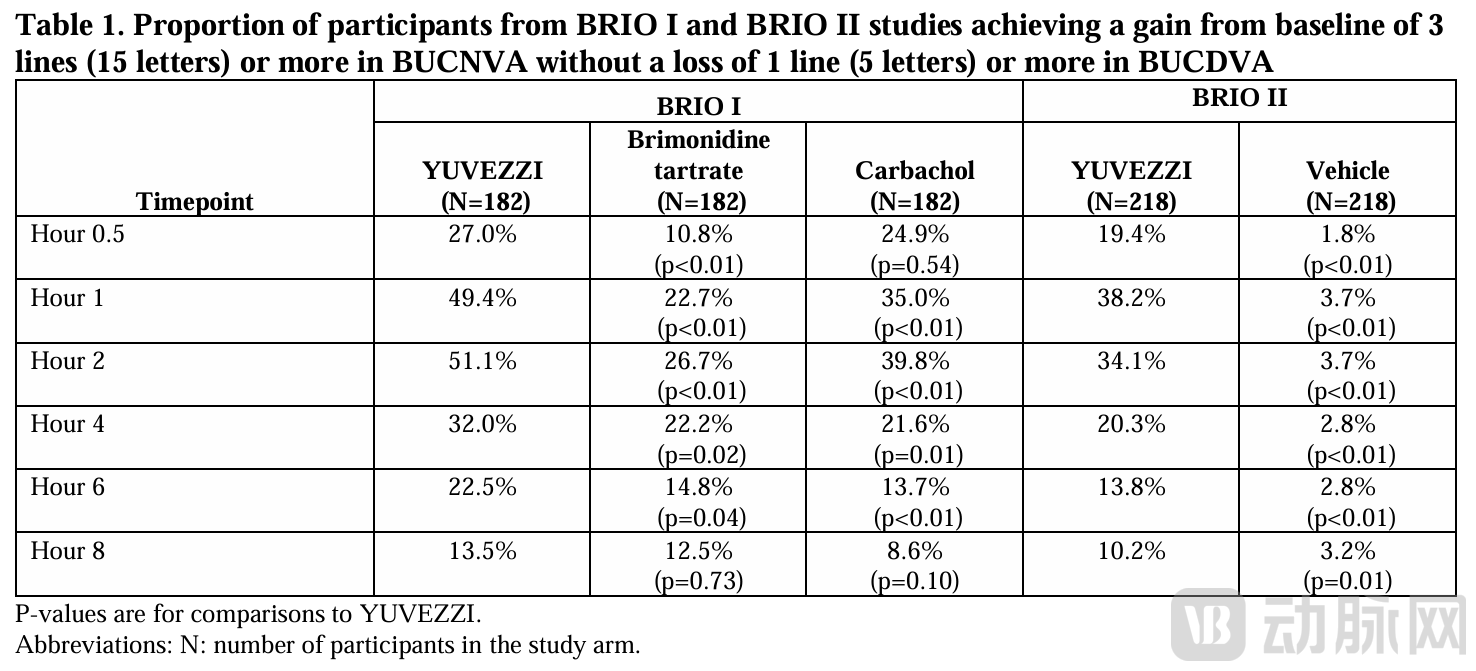
在商业化和使用层面,Yuvezzi以低密度聚乙烯(LDPE)单剂量容器形式供应,每盒包含30支单剂量滴眼液(6袋,每袋5支)。产品建议在2°C-25°C条件下储存,使用前应避光保存;单剂量容器开封后需立即使用,剩余药液应丢弃。
整体来看,Yuvezzi通过复方机制实现对瞳孔大小的精准调控,为老视患者提供了一种无需手术、作用可逆、起效迅速的治疗选择,也助推药物性老视治疗在机制协同和临床可控性方面迈出了新的阶段。
“更可控瞳缩”打造差异化优势
从行业视角看,Yuvezzi的获批不仅是Tenpoint Therapeutics的重要里程碑,也进一步巩固了药物性老视治疗这一细分赛道的可行性与商业潜力。与传统以单一缩瞳机制为核心的方案不同,Yuvezzi通过胆碱能通路与α-肾上腺素能通路的协同调节,实现了对瞳孔大小和动态变化的更精细控制,这一点在其临床研究中体现为持续时间更长、选择性更高且对远视力影响受控的治疗特征。
从差异化角度看,Yuvezzi的核心价值主要在于更可控的缩瞳。在老视这一以功能性视觉改善为主要目标的适应症中,疗效与耐受性之间的平衡尤为关键。Yuvezzi通过复方设计,避免了单一胆碱能药物可能带来的过度瞳孔收缩及由此引发的视觉不适,为长期、重复使用提供了更合理的药理基础。
此外,Yuvezzi在III期研究中采用的复合终点——在显著改善近视力的同时不牺牲远视力,也反映出监管层面对老视治疗产品评价标准的逐步成熟。这一临床和监管路径,可能为后续同类产品在终点设计和获批策略上提供参考。
中国II期临床进行中,商业化在即
早在2022年5月,兆科眼科就与Tenpoint Therapeutics签订独家许可协议,获得Yuvezzi在中国、韩国及指定东南亚地区的开发与商业生产权;随后,在2024年2月,双方进一步扩大合作,将授权区域拓展至更多市场。与此同时,兆科眼科正在国内开展 Yuvezzi用于治疗老花眼的Ⅱ期临床。
2025 年 11 月 6 日,兆科眼科的韩国合作伙伴Kwangdong Pharmaceutical已在韩国提交了Yuvezzi的新药申请,这是该产品在美国以外的首个监管申请。2025年12月8日,兆科眼科宣布与台湾东生华制药达成战略合作。
而此次FDA的批准对兆科眼科而言,此次监管批准将为本公司已建立的商业化策略注入强大动力。兆科眼科当前已为Yuvezzi建立了庞大的合作网络,涵盖亚太地区的八家商业伙伴。此外,FDA的批准亦有助于兆科眼科加速该药物的商业化计划,标志着兆科眼科在全球范围内迈出了重要一步。
关于Tenpoint Therapeutics
Tenpoint Therapeutics, Ltd.是一家全球性生物技术企业,核心业务为推动 YUVEZZI的商业化落地。该产品是全球首款,也是目前唯一一款用于治疗老视的复方滴眼液。老视这一眼部病症,仅在美国就影响近1.28 亿人群,全球受累人群规模约达20亿。Tenpoint Therapeutics立足临床实际需求,与眼科专业医疗人员深度合作,致力于为衰老眼部提供创新治疗方案。
除Yuvezzi外,Tenpoint Therapeutics还有在研管线TPT161和TPT005,分别针对老花眼/白内障和地理萎缩(Geographic Atrophy, GA),其中TPT161是一种多靶向NCE,有望治疗并逆转晶状体蛋白聚集,恢复晶状体的柔韧性和清晰度。
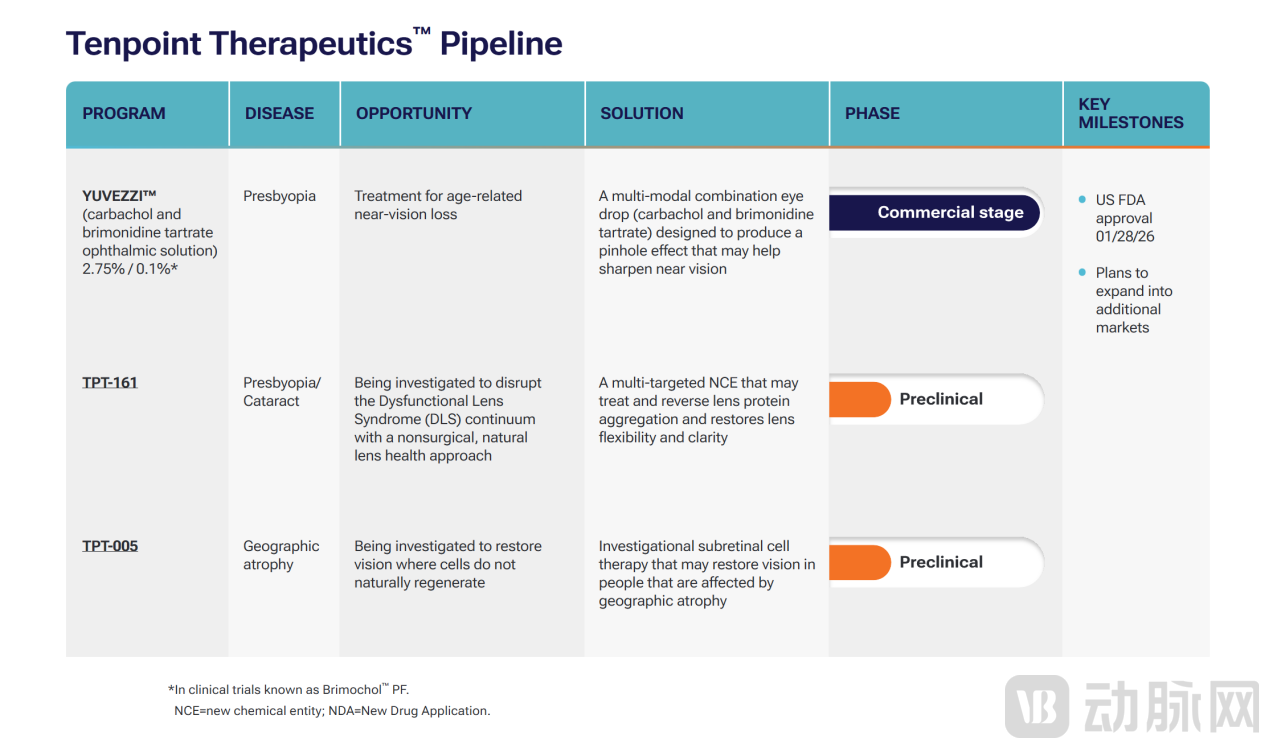
当前,公司还宣布已筹集2.35亿美元的债务和股权资金,以支持2026年第二季度正式上市的Yuvezzi。





























