2021年11月末,全球医药信息咨询和医药会展平台 Informa Pharma Intelligence发布的白皮书《中国临床试验格局》提到了这样一组有意思的数据。
自2016年以来,在中国启动的新临床试验数目每年呈上升趋势,而且增速更快。I-IV期试验启动的总数从2016年的1785项快速增至2020年的3641项。在此期间,年增长率出现了剧烈波动,从2017和2018年超过30%的年增长率,放缓至2019和2020年的个位数。这五年的年均增长率为20%,与2007‒2016年的12%年均增长率相比增幅明显。
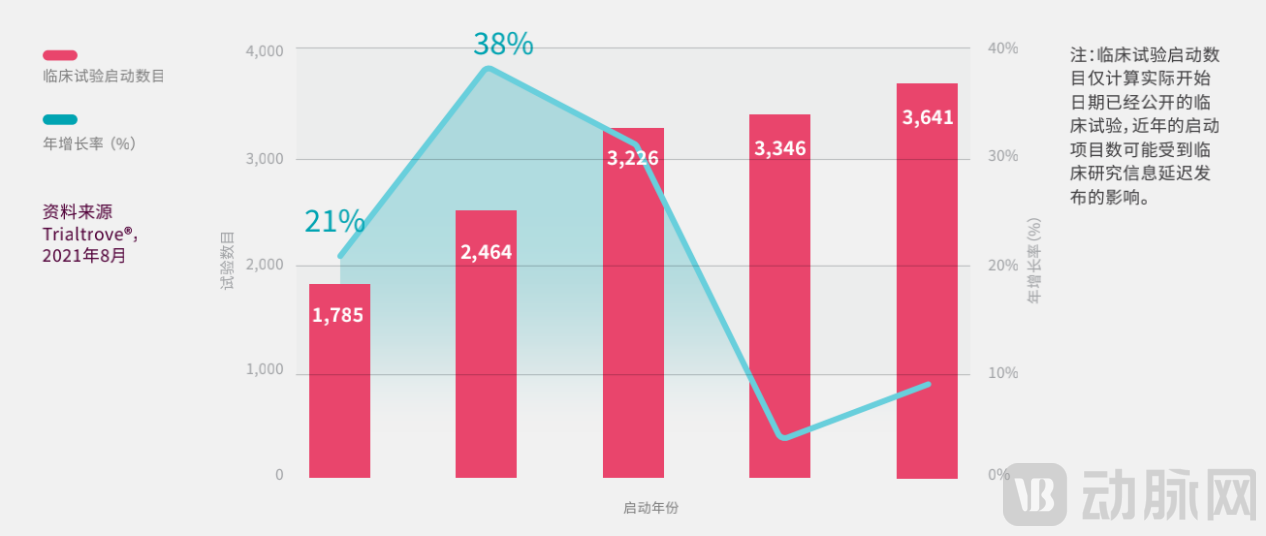
2016年-2020年在中国启动的I-IV期临床试验(数据来源:《中国临床试验格局》)
长期以来,汇聚众多百年药企的欧美一直是展临床试验开的主要发生地,但自21世纪以来,中国临床试验数量呈逐年递增的趋势,从2007年至2016年增长达三倍之多。换言之,中国的制药业正以难以想象的增速崛起。
高速增长背后的驱动力是什么?意义是什么?中国的临床试验格局又将迎来怎样的变化?近日Informa开展的网络研讨会对其发布的《中国临床试验格局》及《2020年临床试验综述:试验格局受到的影响》两份白皮书进行了深究。探讨之下,我们或许能从数据背后,找到更多不为人知的答案。
2016年-2020年,不仅是中国经济飞速发展的5年,也是中国临床试验市场蓬勃发展的5年,业内将这段时间称作临床试验发展的“黄金期”。
在这期间,中国先是加入了ICH(人用药品注册技术要求国际协调会),在临床试验方面加强了与国际领先机构的合作;后又有国务院支持,先后出台了《国务院关于改革药品医疗器械审评审批制度的意见》、《药物临床试验机构管理规定》等多项深化医药改革与鼓励创新的政策;再则是创新药研发喷涌而出,临床试验需求急剧膨胀……凡此种种,无一不推动中国临床试验市场深入进行供给和需求侧的结构性改革。
白皮书用数据给出了更详细的证据:2016至2020年间,在中国启动的临床研究数目明显增加,时间上与时称国家食品药品监督管理总局(CFDA)(后更名为国家药品监督管理局(NMPA))开始进行大规模改革的时期相吻合。
据Informa Pharma Intelligence高级经理周淑华博士表示:药监局采取了一系列措施来确保临床试验数据的真实性、可靠性和完整性,提高监管透明度,同时鼓励创新药品研发,吸引跨国药企(MNC)在中国开展国际多中心临床试验。以强而有力的合规监管、药品临床试验的管理规范及优质的数据作为支撑。此次改革开启了中国临床研究的新时代,也带来了国内制药行业的转变,由生产仿制药与活性药物成分(API)为主转变为高科技研发模式,许多公司开始研发创新药物与生物制剂,而中国也逐渐成为许多创新药物的诞生之地。
总的来说,政策和需求的双轮驱动着中国临床试验的车轮滚滚向前,加之监管、临床试验流程和数据管理方式不断优化完善,国内企业从临床试验中挖掘的价值逐年上升,进而推动中国临床试验市场的高速增长。
生物等效性(BE)研究是推动临床试验数量增加的另一个重要因素。过去的5年间,BE试验数量增长了3倍以上,这主要是源于国内仿制药质量和疗效一致性评价政策的执行。一致性评价与带量采购挂钩,加之带量采购成为新常态,BE试验数量将会持续增长。
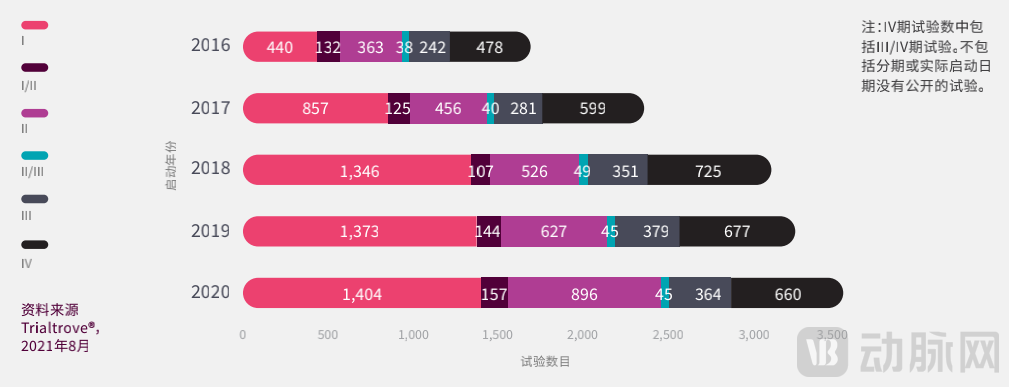
2016年-2020年启动的临床试验分期(数据来源:《中国临床试验格局》)
即便剔除I期BE试验的影响,只统计新药的I期临床试验,增长仍然非常可观,总体增长率 达到了136%。其中由中国药企申办的I期试验(非BE)数目更增长了156%,这正是中国制药行业转向创新药物研发的结果。
具体到治疗领域,Trialtrove分析报告统计的中国启动临床试验的主要治疗领域(TA)数据(2016年-2020年)显示,中国在肿瘤临床试验的数量明显领先,占所有试验(按TA分组)总数的40%,而在非中国地区,这个数字为27%。
心血管是中国重视的另一主要治疗领域,相关试验占所有试验总数的13%,略微领先于非中国地区的9%。
其他诸如传染病、代谢/内分泌、自身免疫/炎症等治疗领域,中国均与非中国地区持平或略少,差距较大的是中枢神经系统这一治疗领域,中国:非中国的比例为12%:20%,白皮书认为,这可能是因为相关药物目前在中国的市场较小。但随着中国愈发注重阿尔茨海默氏症、帕金森症等神经退行性疾病的防治,后续临床试验可能会随政策的改变而增多。
仔细分析中国在研的抗癌药,会发现处于研发阶段的肿瘤免疫治疗数量非常多。在2016年-2020年间,靶向PD-1/PD-L1药物的临床试验数量也非常惊人,占所有肿瘤试验的20%,过度的竞争可能并非好事。
白皮书认为:考虑到可瑞达(Keytruda,帕博利珠单抗)、欧狄沃(Opdivo,纳武利尤单抗)等进口药在中国的价格相对比较昂贵,中国药企已抓紧机遇开发新型、价格具有竞争优势的PD-1药物。
2021年8月,第五款国内开发的PD-1/PD-L1抑制剂已经在中国获批,至于还有多少竞品能够获批上市,目前尚未可料。
“黑天鹅”新冠疫情席卷全球,对全球临床试验格局造成了破坏性影响。患者招募受阻、临床试验被叫停导致试验数据、试验的完整性受到侵蚀……全球对临床试验的参与基本随疫情走向波动,同时也受到经济、医疗资源等因素制衡。
Informa Pharma Intelligencede 另一份白皮书《2020年临床试验综述:试验格局受到的影响》对新冠疫情时期的临床试验数据变化进行了描述。虽然受新冠疫情影响,全球临床试验举步维艰,但截至2021年6月14日,I-III期临床试验同比增长26%,但多数是新冠治疗和预防干预评估试验,非新冠试验数目有所减少,直到2020年末呈略微增长之势。
从全年数据来看,癌症仍是行业的重点,2020年唯一出现增长的其他疾病领域是心血管领域,增长了12%。其他所有TA的试验数目减少了3‒8%。
在这场考验中,中国的临床试验数量逼近美国,但差距较2019年大幅收窄。究其背后原因,Informa Pharma IntelligenceMBA 亚太内容总监Annie Siu 博士在会上表示:“中国在防疫方面的有效处理帮助其经济生活迅速回归常态,有效推动了药企进行心血管、肿瘤等TA方面临床。此外,尽管中国没有大量的新冠肺炎患者,但通过与其他国家合作的模式,中国的传染病临床试验数量同样处于前列,也得到了包括药物、疫苗等一系列新冠肺炎的相关成果。”
 各国临床试验开展数量(数据来源:《2020年临床试验综述:试验格局受到的影响》)
各国临床试验开展数量(数据来源:《2020年临床试验综述:试验格局受到的影响》)
过去五年内,大多数中国展开的临床试验都是由总部位于中国的公司发起。白皮书显示,排名前十位的申办方中,有八个是中国药企,这表明中国药企愈发重视临床试验。
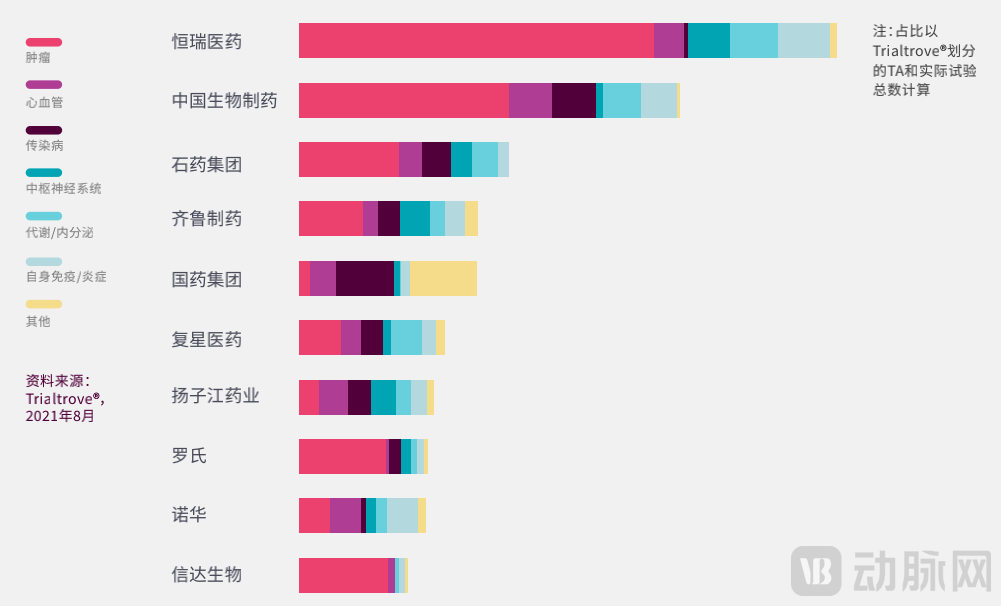
2016年-2020年中国临床试验数量居前十位的申办方,其临床试验的治疗领域(图片来源:《中国临床试验格局》)
同时,中国药企遵循着“模仿-跟随-超越”的升级路径不断发力,正由仿制药大国向创新药大国加速转型,一点一点地提升其在国际市场的竞争力。
尽管目前中国药企与制药行业巨头存在一定的差距,但随着国内药企技术的成熟发展与丰富的临床数据支撑,中国药企赶上制药行业巨头并登上国际舞台或许只是时间问题。
不过,在这个高门槛、长周期、高研发成本的赛道中,随着中国医药创新进入深水区,市场将会对这些后进者提出更高更细致的考核标准。例如疗效、安全性、价格等细节,均需中国药企谨慎处理。
加入全球市场伴随而来的挑战同样显而易见的。外部环境复杂多变,海外临床试验不仅成本比国内高出数倍,难度随之陡增。例如,由于中国开展的临床试验的受试者一般来自国内,国外监管机构在审批时有可能会要求种族敏感性分析等数据。白皮书预测,将来会有越来越多的中国药企会自行开展国际多中心临床试验(MRCT),或选择与海外合作伙伴开展全球的临床试验。
那么,中国什么时候才能赶上制药行业巨头并登上国际舞台呢?
那么从本次更新分析来看该预测是否已成为现实?白皮书给出的答案是“已经部分实现”。
数据显示,2016-2020年间中国新启动的试验数量快速增长,年均增长率达20%之多,虽然目前似乎增速有点放缓,但启动试验的总数仍处于历史最高水平。
通过分析Trialtrove的全球数据,我们进一步发现以中国作为试验地点的比例在过去五年翻了一倍,由2016年占全球总数的13%,上升至2020年的26%。尽管今年的增速开始放缓。与其他主要地区相比,中国的新冠疫情管理得当,社会活动未出现长时间的“中断”,因此,中国亦提前进入“后疫情正常化”,相信有利于临床试验的开展。
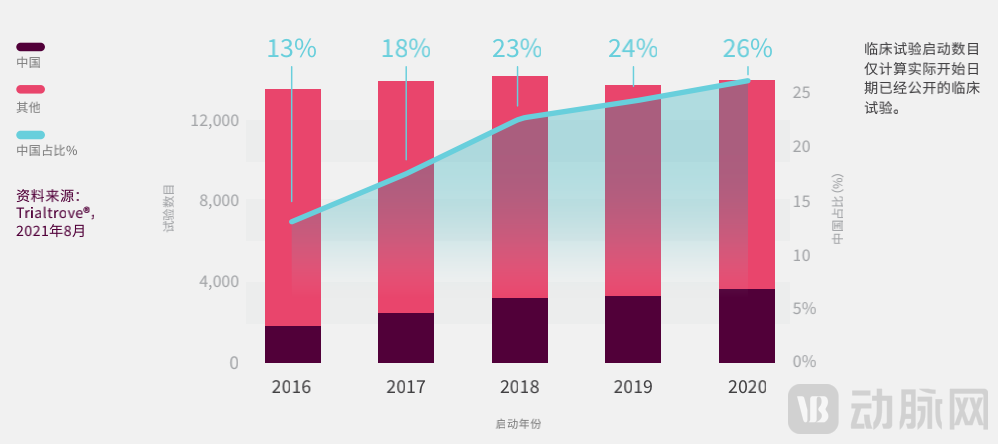
2016年-2020年中国占全球试验数量的份额增长(图片来源:《中国临床试验格局》)
如果中国医药市场按照预期持续增长,中国的临床和监管环境将对中国药企和MNC越来越具吸引力。尽管增长斜率有所放缓,但在未来三年,中国在全球临床试验的比例有望进一步增长。而中国本身,也将在全球生物制药的角逐中,成为不可忽视的一股力量。




























