Moderna和BioNTech在新冠疫苗上的成功,将mRNA这一曾被视作边缘或前沿的技术平台推向了全球疫苗创新研发的舞台中央。新冠疫情期间,国内的mRNA行业也迎来了资本热潮和快速扩张,根据BridgeBeijing行业报告,截至2023年3月,中国已有57个本土mRNA疫苗项目处于不同阶段,并有至少34家机构或公司参与到mRNA新药研发中。
但随之而来的是临床遇挫与资本退潮、预防性疫苗内卷、肿瘤疫苗尚未突破等挑战,行业正经历周期性调整。国内不少mRNA公司开始调整方向、探索in vivo CAR-T、蛋白替代等其他适应症或应用领域,以降低对单一新冠/传染病疫苗的依赖。
在这样的背景下,纳美信生物(NanoRibo,下称“纳美信”)显得有些“异类”。在行业低谷中坚持前行,纳美信不盲目追逐市场热点,不以短期融资为目的,而是把眼光放在临床未满足且能突出mRNA技术平台优势的疾病领域及其长期研发转化上。
这家2021年创立于上海的生物科技企业,研发的呼吸道合胞病毒(RSV)mRNA疫苗于2024年底获国家药监局临床试验默示许可,是世界范围内首个获批临床的冻干剂型RSV mRNA疫苗。2025年,纳美信正式启动该疫苗的I期临床研究,以实际行动诠释着对创新管线的坚定投入。
疱疹病毒研究积淀赋能,产业化经验加持
“我们想做的,不是为资本市场准备一个故事,而是要做出真正有临床价值的产品。”联合创始人兼CEO邓明这样概括纳美信的初心。
在他看来,药物研发是一个长周期、重投入的过程,如果仅为“申报一个临床(IND)”而急于求成,往往会导致资源浪费。纳美信选择的方向,是建设一个能够真正走通从实验室到临床再到产业化的平台型公司。
团队是纳美信最突出的核心优势,创始团队兼具深厚科研背景与药企产业化经验。这样的双重积累,让纳美信在成立初期便能搭建起较为完整的研发和CMC(化学、制造与控制)体系。
CEO邓明拥有15年企业管理与资本运营经验,坚持药物研发的产业化路径;CSO钱志康博士在疱疹病毒领域研究超20年,也是国内最早进入mRNA创新领域的科学家之一;CMC负责人刘军博士曾任职于优时比、赛诺菲、药明康德等企业,擅长工艺开发与注册申报;研发VP马光刚博士曾在勃林格殷格翰等跨国药企领导早期研发工作,熟悉临床前与早期临床开发流程;团队还有GSK疫苗原副总裁Jeff Ulmer博士等多位行业资深顾问。
过去四年,随着国内mRNA行业由热转冷,纳美信生物在波动的周期中保持研发投入,以有限的资源高效推进技术平台建设与管线落地。
筑基(2021~2022):以AI序列设计、LNP创新递送、冻干工艺为抓手,搭建完整mRNA研发平台,并完成专利布局。
蓄力(2022~2024):以RSV疫苗等成药可行性高的重点管线为契机,验证企业的研发能力,向临床应用递进。
破局(2025~至今):在推进RSV疫苗I期临床的同时,深度挖掘能充分发挥mRNA技术平台优势的临床痛点和应用领域。
AI与冻干工艺创新,补齐mRNA疫苗研发短板
mRNA药物研发的关键在于序列设计和递送系统。
纳美信建立的AI与生信平台,不仅仅关注mRNA本身,更关注“目的蛋白”——从目的蛋白位点突变、序列改造与结构预测,到mRNA的3’-UTR、5’-UTR、Poly-A、密码子优化等环节;再到表达量、表达时长、翻译效率与免疫反应调控。在这一过程中,纳美信开发了CodonBox和AntigenBoost等工具,用以指导设计与验证实验,逐步形成可复用的研发体系。
另一项技术壁垒在于LNP(脂质纳米颗粒)递送体系。mRNA分子本身极易降解,必须依赖LNP保护并进入细胞。但全球已上市的多款mRNA疫苗需要在-20℃甚至-70℃的冷链条件下保存,这大大限制了产品的可及性和产品推广潜力。
纳美信自主开发冻干工艺,使mRNA疫苗可以在2–8℃环境下长期稳定储存。目前,公司已取得超过18个月的稳定性数据,且各项指标保持良好,预计效期大于36个月。这意味着在运输和储存环节,疫苗的成本和难度大幅降低。
纳美信的研发逻辑建立在平台迭代与管线梯队滚动之上,二者相互支撑。公司围绕AI驱动的mRNA序列及蛋白(抗原)设计、LNP递送系统和冻干工艺等核心技术持续优化,使平台升级能直接转化为管线研发效率和质量的提升。
图1:纳美信mRNA相关平台技术示意图
聚焦RSV、HSV临床刚需,布局代谢疾病、肿瘤等治疗领域
在管线布局上,纳美信采用“梯队滚动”模式:一方面分散单一管线的风险,另一方面通过不同阶段管线的推进不断积累全流程经验。目前,RSV(呼吸道合胞病毒)疫苗已进入临床阶段,HSV(单纯疱疹病毒)疫苗等早期项目也在平台支持下稳步推进,同时公司正探索mRNA在呼吸道联苗、代谢疾病及肿瘤等领域的应用。
1RSV疫苗:mRNA技术回应临床刚需,冻干工艺破局冷链困局
RSV(呼吸道合胞病毒)是导致婴幼儿下呼吸道感染的重要病原,据WHO数据,每年在全球范围内造成超过360万例5岁以下儿童住院,约10万名儿童死亡,其中97%发生在中低收入国家。
此前,GSK重组蛋白疫苗Arexvy、Moderna mRNA疫苗mRESVIA获批上市,率先跑通了RSV疫苗的全球防疫路径。但是,高昂价格、超低温储运条件等仍是广泛临床可及性的阻碍。
纳美信选择RSV作为首批临床管线,核心在于mRNA技术与冻干工艺的双重适配性:一方面,mRNA技术可通过AI驱动的PreF抗原优化,较传统重组蛋白更高效诱导产生中和抗体;另一方面,其自主研发的LNP冻干工艺突破行业瓶颈,使NR222(RSV疫苗)能在2~8℃常规冷链下稳定保存24个月以上,直接解决基层防疫部门缺乏超低温设备的痛点。
在动物实验中,该疫苗在棉鼠模型中显示出良好的保护效果,甚至优于部分已上市重组蛋白疫苗。2024年底,NR222获批进入临床,2025年已进入I期试验。
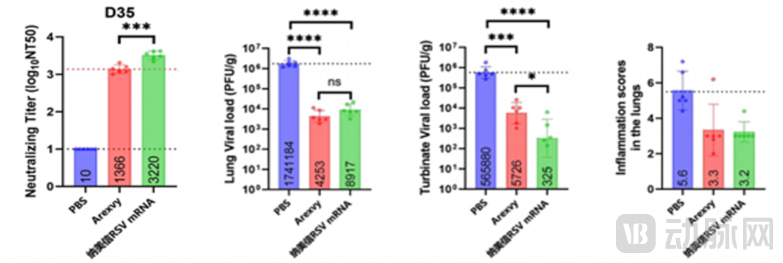
图2:在头对头比较研究中,NR222优于GSK上市的重组蛋白产品
2HSV疫苗:学术积淀推进科学攻坚,多抗策略挑战潜伏难题
HSV-2(Ⅱ型单纯疱疹病毒)疫苗研发更具挑战。据WHO统计数据,全球约有5.2亿人(15–49岁)感染HSV-2,这一病毒不仅引发生殖器疱疹,还会使HIV感染风险增加约3倍。但由于病毒潜伏于骶神经节,感染后可在神经细胞内形成终身潜伏,逃避宿主免疫系统识别,即便是GSK等跨国药企也曾在三期临床折戟,被视为疫苗研发的科学无人区。
纳美信的切入源自长期学术积累。CSO钱志康博士在疱疹病毒研究上深耕20余年,团队从建立动物感染、复发模型入手,同时建立多维度免疫评价方法;不同于传统疫苗单抗原策略,公司通过AI的设计、优化,并在多抗原组合筛选中发现了自己的解决方案。
目前,动物模型结果显示出较强的保护潜力,项目正加速推进至临床前阶段。
3治疗性疫苗、代谢疾病与肿瘤:mRNA的想象力
除RSV疫苗和HSV-2治疗性疫苗外,纳美信生物在管线布局上始终围绕mRNA技术适配性展开深层思考,聚焦能凸显mRNA技术优势的领域推进长期探索。团队对mRNA技术的核心特性有着清晰认知:其通过体内自主表达蛋白发挥作用,在需精准调控蛋白表达、快速响应靶点变化,或传统技术难以突破的场景中,具备独特价值。
这种“以技术特性匹配临床需求”的布局逻辑,既体现了纳美信生物对mRNA技术的深刻理解,也确保其每一项探索都能围绕技术优势展开,避免陷入为拓展而拓展的同质化竞争。
以长期主义锚定mRNA疫苗差异化路径
成立以来,在mRNA赛道中,纳美信生物依靠精细化运营与团队经验实现了高效的资源配置。在保障研发质量与数据可靠性的前提下,公司高效推进全球首个冻干剂型RSV mRNA疫苗进入临床。
年初,纳美信生物通过A轮融资夯实资金基础,正谋求进一步融资,以支持管线进入关键的临床验证阶段。但如何在后期维持研发节奏,仍是现实考验。与此同时,RSV赛道竞争激烈,辉瑞、GSK、Moderna等产品已先后上市,纳美信要突围,必须在创新、成药性及临床价值上形成差异化。
“宁可慢一点,但科学不能含糊。”CEO邓明常用这句话提醒团队。据团队透露,RSV冻干工艺放大阶段曾面临技术挑战,研发团队坚持不更改剂型的原则,通过多轮稳定性测试验证工艺一致性,最终该疫苗的冻干剂型顺利通过监管部门技术审评。这种谨慎背后,是长期主义的坚守。
未来,纳美信计划在2026年推动RSV疫苗进入Ⅱ期临床,并继续深耕HSV等新管线。更长远的目标,是从生物学机制出发,通过源头创新,利用mRNA技术平台优势,解决未成药、难成药的临床痛点问题,真正实现创新平台、创新研发、普惠新药。
在mRNA行业回归理性的周期中,纳美信以冷静务实的长期主义实践印证:穿越周期的关键,或许不是追逐风口的速度,而是对科学与产业化持续打磨、稳步前行的坚守。





























