近日,跨国医疗巨头强生公司(Johnson & Johnson)宣布将以30.5亿美元现金收购专注于新型靶向治疗的生物科技初创公司Halda Therapeutics。
这家初创公司由耶鲁大学Craig Crews教授创立,其创新的RIPTAC(受控诱导近接靶向嵌合体)药物平台通过“hold and kill”机制精准靶向癌细胞,目前核心管线是用于治疗转移性去势抵抗性前列腺癌(mCRPC)的口服候选药物HLD-0915。
Halda刚在10月公布首批临床1/2期数据,显示该药在多线治疗无效的晚期前列腺癌患者中安全耐受,部分患者的前列腺特异性抗原(PSA)和循环肿瘤DNA(ctDNA)水平均显著下降。
Halda Therapeutics:蛋白降解先驱再拓新途,RIPTAC破解抗癌耐药困局
Halda Therapeutics成立于2019年,由分子生物学家Craig Crews创立。Crews教授早年联合创立了开发多发性骨髓瘤药物Kyprolis(Proteolix公司)和全球首例PROTAC新药公司Arvinas,被认为是靶向蛋白降解领域的开创者。Halda的名称源自古北欧语中“to hold(持握)”之意,寓意其研发的RIPTAC药物能够“钩住”两种蛋白并发挥作用。
据官网介绍,RIPTAC是一种双功能小分子,一端结合肿瘤特异性蛋白、一端结合细胞必需蛋白,两者被紧密拉拢形成全新的三元复合体,关闭关键功能蛋白的活性并诱导癌细胞死亡。这一机制直接面向“不可成药”靶点或伴随耐药出现的分子,通过制造新型蛋白-蛋白相互作用来克服传统精准疗法易失效的局限。
Halda的研发重心是口服RIPTAC抗癌药物。目前其管线最先进的候选药物HLD-0915,靶向前列腺癌常见驱动因子雄激素受体(AR)和关键转录因子BRD4。HLD-0915设计成一端结合AR(在前列腺癌细胞中高表达),另一端结合必需蛋白BRD4,形成三元复合体并在肿瘤细胞内关闭BRD4功能,从而选择性杀灭前列腺癌细胞。重要的是,这种“hold”机制不依赖于肿瘤驱动突变;即使AR发生变异,HLD-0915依然能有效诱导BRD4丧失功能并发挥抗癌作用。
在动物实验中,口服HLD-0915可使前列腺癌肿瘤缩小、PSA水平下降,同时显示出优良的治疗指数。Halda已在今年9月启动了HLD-0915的1/2期临床试验,初步数据显示,HLD-0915耐受良好,已经观察到多名晚期患者的PSA和ctDNA水平明显下降,并有患者影像学上出现部位肿瘤缩小。目前HLD-0915已获美国FDA授予快速通道资格,正在评估用于mCRPC的更早期治疗线。
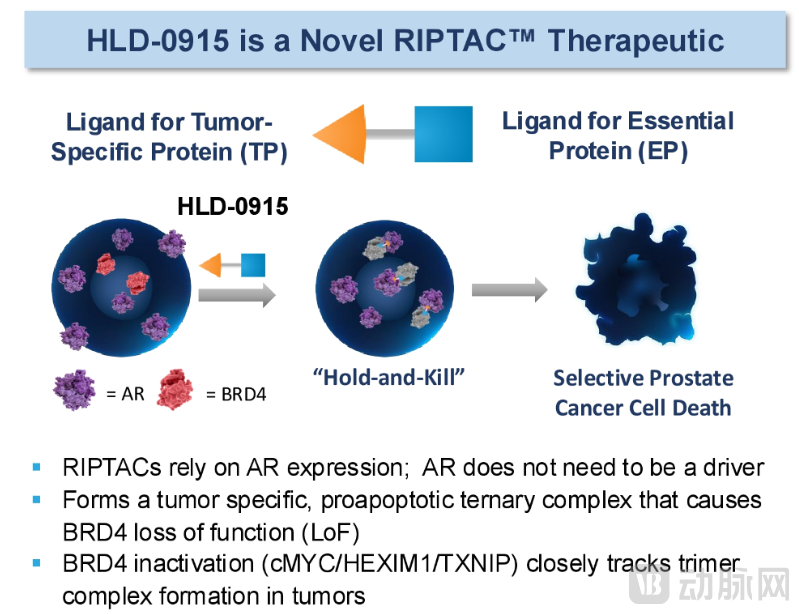
Halda首个RIPTAC候选药HLD-0915通过“持握-杀死”机制发挥作用。
(一端以雄激素受体(AR)为肿瘤标志物,定位前列腺癌细胞,另一端结合关键蛋白BRD4,形成三元复合体并抑制BRD4功能,选择性触发前列腺癌细胞死亡。)
除前列腺癌外,Halda管线中还有针对雌激素或孕激素受体阳性(HR+)转移性乳腺癌的RIPTAC项目,处于临床前至临床前优化阶段。公司宣称利用在乳腺癌细胞中高表达的标志蛋白,使该RIPTAC能够将杀伤活性聚焦于肿瘤区域并触发癌细胞死亡。
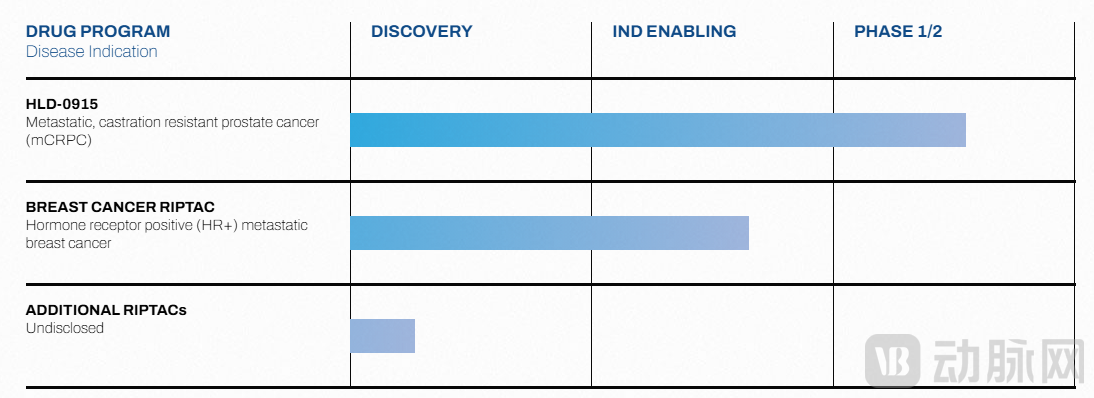
Halda管线进展一览
目前,Halda累计融资超2亿美元,其主要投资者包括Canaan、Access Biotechnology、Deep Track、Frazier、RA Capital、Vida Ventures、Boxer Capital和泰和创投等。从创立到获业界认可,Halda吸引了生物医药领域的资深管理者加盟,例如CEO Christian Schade曾任Flagship Pioneering合伙人。
强生:年内两度大额并购,锚定创新疗法
近年来,为应对其核心药物如免疫疾病重磅药Stelara失去专利独占权的挑战,强生积极进军高增长治疗领域。此次收购是强生今年第二笔重磅交易。
今年1月,强生以约146亿美元收购脑神经药物开发商Intra-Cellular Therapies,获取其已上市的抑郁症药物CAPLYTA及在研项目。此次收购Halda是强生2025年的第二个重磅收购案;此外,去年强生还以131亿美元收购了心脏病介入器械商Shockwave Medical。显而易见,强生正通过一系列并购在创新药物和高端医疗器械领域快速扩张,寻找新的业绩增长点。
在肿瘤领域,强生拥有强大的研发管线和产品组合:其前列腺癌主要药物包括Zytiga(阿比特龙片)、Akeega(尼拉帕利+醋酸阿比特龙)和Erleada(阿帕鲁胺)。此外,强生还收购了抗PSMA抗体偶联药物ARX517(2024年以20亿美元并购Ambrx获得),在研项目中还有靶向KLK2的双特异抗体pasitomig等。
总的来说,强生在前列腺癌治疗领域已经建立了深厚基础。此次选择收购Halda,不仅是看中了RIPTAC这一全新药物模式,也表明强生有意用创新疗法弥补传统治疗手段的局限,Halda的技术与强生现有肿瘤药研发实力相吻合,是公司所寻求的中长期催化剂。同时,强生管理层也强调此次并购符合其偏好——即在已有内部能力和专业知识的领域内进行创新并购。可以预见,Halda收购完成后,新平台将与强生现有管线进行整合,以丰富其精准肿瘤治疗组合。
TPD技术锋芒渐露,抗癌领域成核心潜力赛道
强生巨资入局Halda背后,是靶向蛋白质降解(Targeted Protein Degradation,TPD)领域的热潮和不断增长的市场需求。
从宏观来看,全球癌症药物市场规模庞大并持续高速增长。IQVIA报告指出,2024年全球癌症治疗药物支出已达约2520亿美元,并预计到2029年将增长到4410亿美元;美国癌症协会预计2025年新增癌症病例将达约200万例。与此同时,TPD技术获得越来越多制药企业和投资者的青睐。市场研究机构Mordor Intelligence预测,全球靶向蛋白降解市场规模在2024年仅约5.44亿美元,2025年增至6.5亿美元,到2030年有望达到16亿美元左右,并且约60%的活跃蛋白降解项目聚焦于肿瘤领域。
这些数据表明,TPD技术尤其在抗癌方向潜力巨大,多个案例佐证了这一趋势:例如Crews教授早前创办的Arvinas公司已经在前列腺癌和乳腺癌PROTAC药物方面取得进展,2024年其抗AR PROTAC药物完成了II期临床;Kymera Therapeutics等公司也在积极推动多款降解剂进入临床试验。
展望未来,靶向蛋白降解在肿瘤领域的前景被普遍看好,但仍需大量临床验证来验证其疗效和安全性。强生对Halda的注资不仅是对这一新兴技术的信任,也有望加速这一领域的研发速度。





























