溶瘤病毒(Oncolytic Virus, OV),一类能选择性地感染并杀死肿瘤细胞而不损伤正常细胞的天然或重组病毒,具有特异性复制能力,激发机体产生抗肿瘤免疫反应。
距离人类首次发现病毒溶瘤这一抗癌策略已过去百年。百年内,溶瘤病毒(Oncolytic Virus,OV)经历了两次迭代,从天然野生型病毒到减毒的基因重组病毒,再到利用基因编辑,搭载有效载荷,聚焦减毒和杀伤癌细胞的第三代溶瘤病毒。
截至2023年7月,国内有11个溶瘤病毒管线新获批临床(包含国内外获批)。
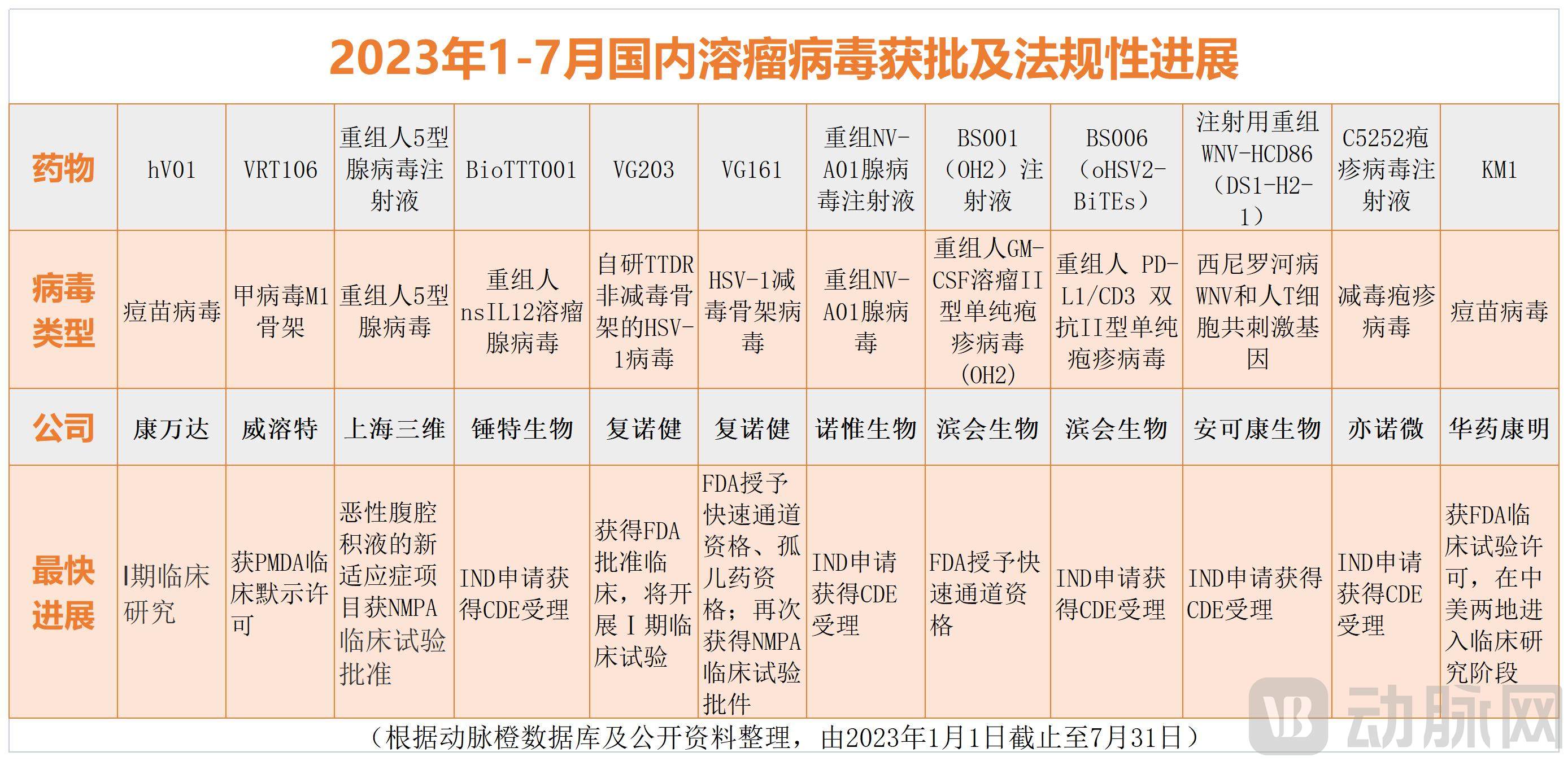
随着第三代及改进版的溶瘤病毒逐步迈入临床,关注的目光重新聚焦。但溶瘤病毒的争议从未停歇:
毒性——减毒更重要还是OV活性更重要?
长期以来,对于OV本身的毒性质疑从未间断。即使OV的临床不良反应率极低,以发热、注射局部反应和流感样症状为主。例如2021年上市的以Delytact®,3级和4级不良事件发生率为26.3%和10.5%。由于担忧毒性,病毒设计会删除毒力基因以增加安全性,存在降低溶瘤病毒活性的可能。更关键的是,因为重视减毒而忽视了疗效的决定性因素——OV活性。
给药方式——瘤内注射还是静脉注射?
在给药方式优劣上,OV的研发团队们各执一词。静脉注射观点认为给药形式更多样、更便捷,临床可及度更高。瘤内注射观点则认为更有利于OV生效,引起瘤内细胞因子风暴,更好发挥改变肿瘤微环境的疗效。此外,根据适应症实体瘤位置,开辟了颅内注射、腹腔内注射、膀胱内注射等多途径给药。
疗效范围——远程病灶疗效和全身性疗效是否能够实现,如何提效增效?
OV的临床前及临床发现远端效应,即局部注射全身起效,在原位肿瘤之外的其他肿瘤病灶上也发现明显疗效。当肿瘤裂解、大量肿瘤抗原释放时,原位肿瘤成为免疫中心(vaccination center),大量免疫细胞被招募,“习得”肿瘤抗原识别,以作用于全身远端病灶。这一认知让OV从局部治疗进化至系统治疗。
疗效——如何更好改善免疫抑制性肿瘤微环境,将“冷肿瘤”变为“热肿瘤”?
随着研究试验深入,众多研发团队对于OV疗效有了更为深入的认识——OV疗效发挥不只是溶瘤本身,更重要的还是对于肿瘤内免疫抑制性环境的改善。通过改善肿瘤微环境(TME),OV可以与其他免疫疗法联用、协同增效,将“冷肿瘤”变为“热肿瘤”,使原先对于免疫治疗药物反应欠佳的瘤种变得敏感。
基于争议的不断改善,溶瘤病毒正迎来第三次迭代——利用升级改造的病毒骨架,搭载数量更多和种类多样化的有效载荷(payload),提高溶瘤活性,激活更强的机体免疫。2015年创建的复诺健,深耕溶瘤病毒免疫和mRNA平台研发,迄今已融资逾3亿美元。
“复诺健做的核心事情就是把抗病毒的免疫变成抗肿瘤的免疫,通过表达细胞因子等payload,去改变肿瘤微环境,将进来的免疫细胞从抗病毒转向为抗肿瘤。”复诺健联合创始人兼首席科学官贾为国博士介绍。
初代OV管线:搭载多个协同性外源基因
2023年2月,初代溶瘤病毒管线VG161获美国FDA孤儿药认定,用于治疗肝内胆管癌(ICC)。6月被授予FDA快速通道资格(FTD),用于治疗经标准治疗失败的晚期肝细胞癌。
VG161是首个搭载4个外源基因的HSV-1减毒骨架病毒——IL12、IL15/15RA(IL15和IL15受体α亚基)和PD-L1阻断肽(PDL1B)。依靠于IL12和IL15的协同表达,VG161将能够激活T细胞、NK细胞等一系列免疫细胞,刺激免疫反应,改善肿瘤微环境,增强抗肿瘤疗效。
在标准治疗中失败并接受VG161单药治疗的肝细胞肝癌(HCC)患者的4个月PFS(无进展生存期)率比历史对照组高20%,中位PFS增加了一倍。且再次接受CPI(检查点抑制剂)治疗的患者与之后未接受CPI的其他患者相比,OS(总生存期)显著延长。
在Ⅰ期临床数据中,在2名患者的注射肿瘤组织样本中检测700个免疫应答相关基因的表达,其中超过300个基因在治疗样本中显著上调,表明多种免疫相关细胞类型上调(包括CD4、CD8、DC),显示出VG161加热肿瘤并增强免疫活性的肿瘤微环境改善作用。
目前VG161已在全球开展10项临床试验,包括针对肝细胞肝癌(HCC)和ICC的Ⅱ期临床试验。在大中华区,复诺健将与国药集团中国生物合作开发VG161的市场。双方合资公司中生复诺健为实际承接单位。同时,复诺健的海外市场也正在积极探索中。
二代OV管线:转录翻译双重调控(TTDR)非减毒骨架
进入二代溶瘤病毒管线,复诺健自研转录翻译双重调控(TTDR)非减毒骨架,以加强肿瘤细胞内的病毒复制,加强肿瘤清除疗效。
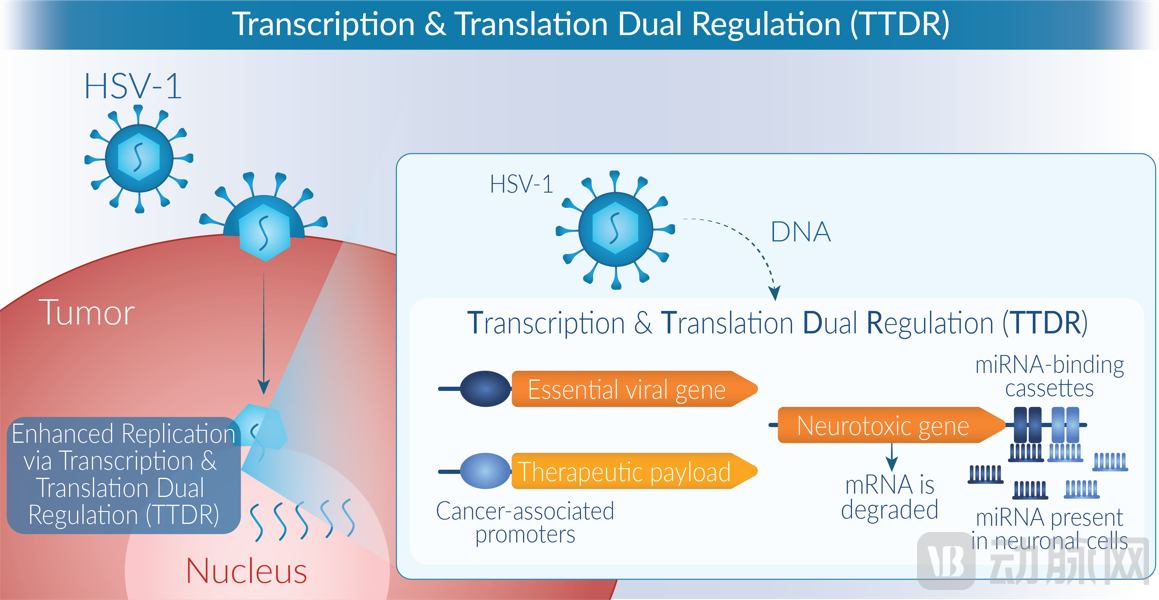 复诺健TTDR骨架原理模型图(受访者供图)
复诺健TTDR骨架原理模型图(受访者供图)
具体而言,使用肿瘤相关启动子,对病毒所需的早期蛋白进行转录水平调控,以增强病毒在肿瘤中的选择性复制。同时通过多个microRNA结合位点控制神经毒力因子翻译,组织功能性蛋白无法形成,以确保安全性。
临床前疗效上,TTDR HSV-1仅需单次给药便可持续抑制肿瘤进展,且以减毒病毒的万分之一剂量给药即可实现肿瘤的完全抑制,显示出强效、可持续的系统性抗肿瘤活性,可诱导免疫记忆,抑制肿瘤复发。全球临床试验已有25名患者接受VG201治疗,未有相关的剂量限制性毒性报告,且在临床单药治疗组中观察到初步疗效结果。
基于TTDR非减毒性骨架,复诺健研发出VG-2XX系列和VG-3XX系列溶瘤病毒管线。目前,VG201已获得NMPA和FDA的临床试验批准,在中、美开展2项临床试验。VG203获得FDA批准临床,将在美国开展针对晚期实体瘤的Ⅰ期临床试验。
三代OV管线:RDE转向器和拓展技术平台VIETATM
推进至三代溶瘤病毒管线,复诺健仍在不断创新,搭载拓展技术平台Re-directing Engager 转向器(RDE)和VIETATM(VIrus-Enabled Target Adaptor)。
通过带有适配器的转向器,溶瘤病毒可以靶向多种类型的肿瘤, 打破实体瘤异质性障碍,与靶向的免疫细胞治疗和抗体药物耦合(ADC)联用。
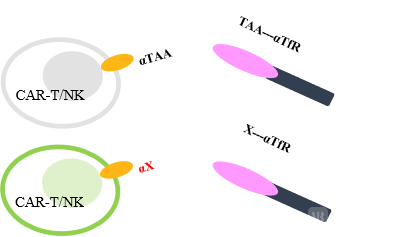
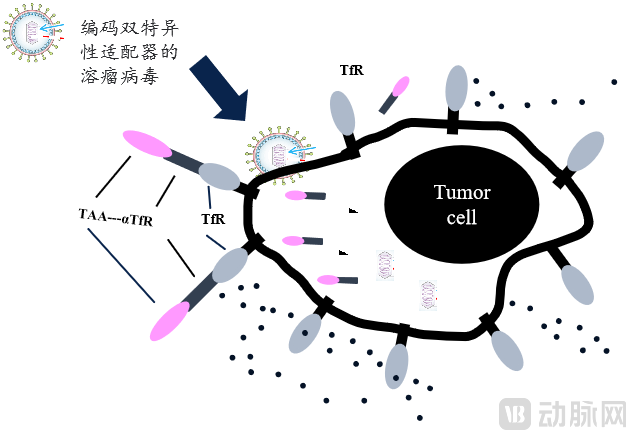
CAR-T/NK靶向Adaptor模型(上)与VIETATM平台模型(下)
Engager,通过表达双特异性抗体或者多特异性抗体,以若干之手“抓住”免疫细胞和肿瘤细胞,利用“旁观者效应”,将免疫细胞从攻击病毒换向攻击、杀死肿瘤细胞。不仅解决了双特异性抗体对实体瘤的浸润问题,也可以降低“在靶脱肿瘤”的系统性风险。
Adaptor(即VIETATM),通过溶瘤病毒释放双特异性分子,一头为铁离子转运蛋白受体,与肿瘤特异性高表达的蛋白结合,“抓住肿瘤细胞”。另外一头表达肿瘤相关抗原,可被CAR-T、CAR-NK或者ADC靶向。因Adaptor以非人源蛋白作为靶标,根本上降低“脱靶效应”毒性的可能性。
VG30X即搭载靶向CD3和CEACAM6双特异性T细胞Engager,预计于明年申报中、美申报临床。

复诺健管线布局(受访者供图)
复诺健联合创始人、首席科学官贾为国博士是利用肿瘤特异性复制特性的溶瘤病毒治疗恶性肿瘤的国际先驱者之一。1991年开始,贾为国博士研究用基因工程方法改造病毒,并首次证明在免疫健全的机体上,基因改造的复制型溶瘤病毒载体仍然可以选择性地攻击肿瘤细胞、达到疗效,为病毒载体使用提供了重要的可行性依据。
1994年9月至2019年6月,贾为国博士任UBC大学脑所资深研究员,UBC大学医学院终身副教授。2015年,作为共同创始人建立了加拿大复诺健生物科技公司。2019年7月辞去了UBC终身教授职位,全职担任复诺健首席科学家。
2019年,复诺健与中国生物合资注册成立了中生复诺健,并从2021年开始研发mRNA新冠疫苗。2023年1月,中生复诺健自研的国内首款编码奥密克戎变异株全长S蛋白创新型新冠mRNA疫苗,正式获得NMPA临床试验批件,开展临床。
复诺健研发团队不仅全程参与了新冠mRNA疫苗研发,而且凭借扎实的科学知识和研发基础,全面优化mRNA、saRNA疫苗平台,提出联合溶瘤病毒+mRNA疫苗,寻求系统性、协同性的抗肿瘤免疫激活。
长期以来,mRNA疫苗一直被视为肿瘤疗法的新可能,优势在于其对于细胞免疫的有效刺激、高表达速度和表达量、无基因组突变风险、研发周期短、生产相对简单等。但mRNA疫苗作为单药治疗还未跑出。
原因之一是,与免疫系统长期共存的肿瘤抗原已形成免疫容忍(免疫耐受)。加之肿瘤微环境的强免疫抑制作用,mRNA疫苗在外周形成的抗肿瘤免疫难以触达肿瘤生效。
溶瘤病毒恰好可以解决这一问题。
复诺健提出prime-boost(异源初免-加强)策略,利用mRNA疫苗建立外周的系统抗肿瘤免疫,同时采用溶瘤病毒打破瘤内免疫抑制,改善肿瘤微环境。一方面让mRNA疫苗的抗肿瘤免疫活性能够更好在瘤内发挥作用,另一方面通过肿瘤细胞的裂解暴露更多的肿瘤抗原,从而强化肿瘤免疫的效果。
目前复诺健已构建多个mRNA肿瘤疫苗,在临床前模型上显示出较好疗效。下一步,复诺健将进入mRNA肿瘤疫苗的CMC和独立研究评估,推进IND申报。
复诺健首席医学官赵荣华博士,曾担任上海三维生物技术有限公司医学部主任,主导了溶瘤病毒创新药物H101和H103的临床前和临床研究。H101(安柯瑞)于2005年获得CFDA 批准上市,为中国药监部门首个正式批准上市销售的溶瘤病毒产品。
赵荣华博士介绍,除加拿大复诺健外,复诺健已创立上海复诺健作为全球研发中心总部,并在美国和澳大利亚建了临床研发中心,即北美区临床团队和亚太区临床团队。
基于全球化布局,复诺健呈现出差异化、互补性的临床结构。“一个是避免重复的临床试验,通过数据共享来加速临床进程。另一个是在不同区域布局不同的高发适应症。”赵荣华博士谈到,未来复诺健也将尝试开启国际多中心的临床试验,并利用抗肿瘤药研究的利好法规,加快产品上市进程,如快速审评、孤儿药资格、突破性进展,有条件批准等。
“最重要的是一定要把潜在的敏感患者群体挖掘、富集起来,也就是寻找标志物依赖。”生物标志物(Marker),溶瘤病毒尚存的另一难题。“生物标志物提示,哪个或哪几个适应症会对溶瘤病毒敏感?同样的适应症中表达哪些生物标志物的患者会对溶瘤病毒敏感?”
例如VG161已在肝细胞肝癌上看到了较好疗效,并从临床数据中发现了可能的潜在生物标志物。带有该标志物患者的中位总生存期长于其他患者一年多。“如果潜在的Marker被证实,并在入组设置新的患者标准,富集潜在的敏感患者。这样的临床研究将更加有效。”
另一角度而言,生物标志物的发现还将改变溶瘤病毒的临床研发策略。“理论上讲,肿瘤标志物表达越高,病毒复制越强,溶瘤能力越强,免疫激活也越强。未来复诺健会在临床数据上探索和验证我们的第二代溶瘤病毒是否有标志物依赖,是否有可能采取篮式设计研究。”
篮式设计研究,生物标记物指导的临床试验,也是应靶向治疗而出现的研究方式。即药物临床试验、甚至获批均不依赖适应症,而是针对表达同一靶点或同一生物标志物的所有适应症。
7月3日,VG203获得FDA批准临床。开展I期临床试验的同时,复诺健关注有望取得更好疗效的CXCR4阳性肿瘤,分析CXCR4表达水平与疗效的关系,积极探索后期开展基于篮式设计研究的可能性。
“在临床上,溶瘤病毒与免疫疗法联合的多通道探索也是重要课题。联用给药顺序、给药剂量等都会影响溶瘤病毒药效,需要大量的临床前和临床研究来证实。当然,第一步首先是溶瘤病毒要跑出单药,我们对此很有信心。”赵荣华博士谈到,溶瘤病毒的研发不只是科学家的问题,还需要建立起行业对溶瘤病毒的整体认知,让更多临床学家和肿瘤学家共同努力。
贾为国博士最后说到,“可能还需要3到5年的时间,更新过的第三代或第四代溶瘤病毒才能够在临床上显示出效果。一旦联合策略在临床上走出亮点,将有一大批肿瘤疫苗走向与溶瘤病毒的合用,免疫疗法已占据的广阔市场也将向溶瘤病毒打开。”





























