阿斯利康的研发主管、生物制药研发负责人Mene Pangalos最近宣布了明年3月退休的计划。
Pangalos在阿斯利康负责除抗肿瘤以外的所有研发工作。2010年,当Pangalos加入这家英国制药巨头时,公司正面临着生死存亡的威胁: 销售额不断下滑、管线乏力,辉瑞企图收购公司。在他的任期内,阿斯利康的收入不断增长,股价也攀升了超过500% 。
Pangalos看到了最大的问题: 阿斯利康的研究没有取得成果。阿斯利康公司通过 III 期临床的成功率为4% ,落后于6% 的行业平均水平。他推动对质量的重视超过了对数量的重视,从2012年到2016年,尽管行业平均水平下降到了4%,但是这种对质量的重视把阿斯利康的成功率推高到了19%。
阿斯利康公司首席执行官Pascal Soriot评价Pangalos,“他推动了阿斯利康的研发转型。”
这就不得不提到2010年, Pangalos加入阿斯利康时推动的一项著名的工作,成果2014年发表在《自然评论-药物发现》上。
“如果我看一下这家公司在2005年到2010年的表现,和其他公司没什么不同,数量是优先考虑的。我们研究了从2005年到2010年的管线项目,试着找出一些影响研发成功率的因素。”Pangalos不久前接受外媒采访时说。“这是‘5R’框架的基础:正确的靶点(the right target)、正确的患者 (the right patient)、正确的组织(the right tissue)、正确的安全性(the right safety)和正确的商业潜力(the right commercial potential)。
第六个因素则是正确的文化(right culture)。“在我们的决策过程中,‘5R’的原则我们已经贯彻的相当的不错。这些年来,文化的转变达到了顶峰。”Pangalos强调。
“研发生产率危机”是业界广泛讨论的话题,从业者或许对阿斯利康的“5R”框架也不陌生,听起来似乎是老生常谈。但是,在国内,这种“研发生产率危机”有另外一种表现形式,那就是靶点内卷,无差异化竞争,以及最后虽然产品能上市,但是商业化失败。
阿斯利康在研究中洞察到,这是因为研发机构向“研发产业化”的转变,这种转变的目的是在保证质量的同时提高效率,但有些组织却使用基于数量的指标来提高生产率。其假设很简单,即如果每十种候选药物进入临床开发阶段,就有一种药物上市,那么将进入开发阶段的候选药物数量增加一倍或两倍,获批药物的数量就会增加一倍或两倍。然而,这种情况并没有发生,因此,研发成本增加了,而产出(以上市药物数量衡量)却保持不变。
阿斯利康在论文中提醒,这种以数量为基础的方法不仅损害了研发管道的质量和可持续性,更重要的是,还损害了研发组织的健康和其潜在的科学好奇心。这是因为科学家和临床医生的工作重心偏离了更高要求的目标,即深入了解疾病病理生理学和治疗机会,转而致力于实现以数量为基础的目标,并确定开发前所未有的备用药物和“跟风”候选药物。在这种环境下,理解疾病生物学的“追求真理”行为可能会被“追求研发进展”行为所取代。
虽然这只是一家公司根据有限的项目,在有限的时间范围进行的一次评估,但是可以说,今天我们讨论的一切,包括差异化竞争、临床需求为导向,早在这个研究里就有系统性的阐述,特别是阿斯利康对于强调“数量大于质量”的行业文化的洞察,今天对我们行业仍然极具启发性。
1
作为战略评估的一部分,2011年,阿斯利康对 142 个药物研发项目进行了全面审查,通过研究项目的数据和决策,了解药物候选品流失的根本原因。
审查涵盖了 2005-2010 年期间所有治疗领域的项目,从临床前研究完成后的阶段,一直到 II期临床试验结束。审查的主要目的是了解项目终止的主要原因,并确定与成功结果相关的项目特征。 出于两个原因,全面审查没有将范围扩大到 III 期。首先,成功地通过概念验证阶段(II期),仍然是整个行业中流失率最高的阶段,必须加以改进。其次,单个公司处于 III 期的项目数量太少,无法得出有效的结论,而如果考察成功上市的药品,这个数字就更小了。
审查工作由来自项目团队的科学家和临床医生组成的跨职能小组,并以同行对同行的方式进行。为了尽可能做到客观,在对团队进行访谈时使用了结构化问卷,其中有 200 多个问题涉及项目的各个方面(例如,候选药物的科学依据、靶点验证和理化性质)。除书面调查外,还对项目团队进行了深入的同行访谈。由经验丰富的科学家和临床医生组成的团队对调查问卷和访谈的答复进行了严格的同行评审,以确保对所有项目进行一致的评估。此外,为了进一步避免任何潜在的偏见,在评估期间与管理决策有关的高层领导没有参与审查。
在分析中,药物研发过程被划分为四个不同的阶段:临床前(GLP毒理到IND)、I 期(完成首次人体试验,包括安全性、耐受性和剂量评估)、IIa 期(早期药物活性评估)和 IIb 期(概念验证阶段,剂量反应)。
在每个阶段,项目被分为 “活跃”(仍处于该阶段)、“终止”(在该阶段失败)或 “成功"”(从该阶段过渡到下一阶段)。每个项目在其发展路径的每个阶段都分别进行了分析;例如,对一个已进入III期试验的项目在整个发展过程中进行了四次分析。
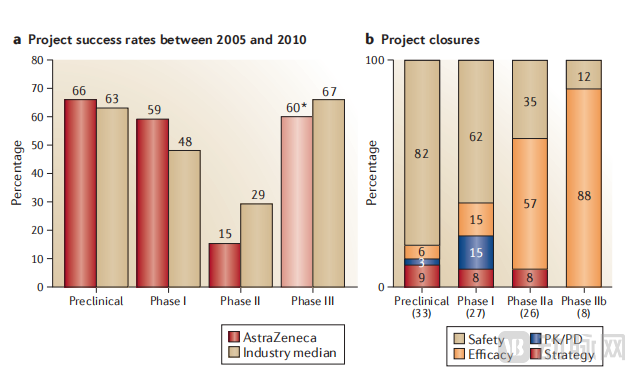
总体而言, 142 个审查的阿斯利康项目中 ,94 个项目在评估期间终止,其中,33 个项目在临床试验前终止, 61 个项目在临床试验期间终止。其余项目在审查时仍在进行中。
阿斯利康将项目的成功率与制药基准论坛(Pharmaceutical Benchmarking Forum)提供的制药行业基准进行了比较。临床前阶段的成功率(定义为完成该阶段并进入下一阶段开发的项目百分比)与行业基准相当(66% VS 63%)。数据表明,与行业基准相比,其完成 I 期的成功率较高(59% VS 48%),但完成II 期的成功率明显较低(15% VS 29%)。此外,III期的成功率也低于行业整体水平(60% VS 67%),尽管这一阶段的项目数量很少。因此,阿斯利康允许更多的项目进入后期开发阶段,但这些项目随后却以失败告终。总体而言,2005-2010 年期间,阿斯利康成功将候选药物推向市场的比例明显低于行业中位数(2% VS 6%)。
2
不在可接受范围内的安全性问题是导致项目失败的最重要原因,占所有终止项目的一半以上。大多数这类失败发生在临床试验之前(主要是在GLP毒理学测试期间),其中82%的临床前项目终止是由于安全问题(需要注意的是,这是项目终止的百分比,而不是所有项目的百分比;2/3的项目成功完成了临床前阶段并进入了临床阶段)。
在I期临床试验中,安全问题同样是主要的失败原因,62%的项目在该阶段因安全问题而终止。安全问题在后续开发中仍然是项目终止的重要原因:在所有终止的项目中,35%的项目在IIa期因安全问题终止,12%的项目在IIb期终止。总体而言,30%的项目在II期因安全问题终止,这一数字显然大大高于报告的行业总体水平(2008年至2010年间项目失败的比例为19%,2011年至2012年间为22%)。此外,安全问题也间接导致了项目的终止 ,因为它限制了化合物在人体中的测试剂量,从而阻碍了充分的药物暴露和靶点的作用。
大多数临床前因安全性问题终止的项目,可归因于特定器官的毒性。心血管毒性是导致此类终止的最常见原因(17%),其次是肝毒性(14%)、肾毒性(8%)和中枢神经系统(CNS)毒性(7%)。总体而言,安全性失败的原因与其他行业的观察结果一致。
在临床前试验期间,75% 的因安全性问题终止的项目与化合物有关(即由于化合物的“非靶向”或其他特性),而不是由于靶点的主要药理作用。相比之下,在临床阶段,与靶点相关的安全性问题比例大幅上升,并且几乎占了与安全性相关的项目终止的一半。这样的失败往往是由于预测的有效剂量和安全结果之间的差距过大,这意味着需要承担不可接受的安全风险的情况下,才能实现靶点作用或患者获益。
此外,研究发现那些在临床前阶段出现安全信号的项目往往因临床安全问题而终止,而那些在临床前阶段几乎没有安全信号的项目则很少因此终止。但应注意的是,缺乏临床前安全信号并不足以预测项目在后期开发阶段的成功与否。
总体而言,分析显示团队需要关注临床前阶段的安全信号,这是一种直观但至关重要的任务,同时还强调,随着项目的进展,安全性的问题会越来越多,从而导致项目延期。分析还表明,一些分子的研究进展本可以通过采用更严格的标准更早地终止。
项目终止的次高原因是在所选择的疾病指征上缺乏疗效。在所有失败的项目中,超过一半的IIa期项目失败和88%的IIb期项目失败是由于缺乏疗效。总体而言,II期临床试验中有65%的项目在因疗效问题而失败:这个比例略高于整个行业的数据(2008年至2010年间项目失败的比例为51%,2011年至2012年间为59%)。
阿斯利康对团队进行了调查,以了解项目未能取得临床疗效的原因。原因是复杂的,团队通常报告了多个影响因素。“最明确”的失败原因是,某个项目能够清楚地证明,药物学参与所提出的作用机制,并没有使接受测试的患者群体获得临床疗效。在这些情况下,40%的项目回应表明团队缺乏证据证明靶点与疾病之间存在明确的联系,或者缺乏对该疾病进行充分验证的动物模型。在这个类别中的项目被认为对于靶点在潜在疾病病理生理学中的作用了解较差;然而,它们也被认为是“有益”的失败,因为测试了假设并证明其是错误的。
相比之下,29%的项目回应表明化合物的特性要么限制了剂量,要么无法确定化合物在相关靶组织中的暴露量。例如,AZD3778是一种新型化学因子受体拮抗剂,用于治疗哮喘,但其药代动力学特性不理想,具有高蛋白结合率,在人体内的半衰期比预期短得多。此外,与该化合物相关的安全性问题限制了人体给药剂量。AZD3778在临床原理证明研究中未能显示出疗效,由于该化合物的特性,无法确定是否已达到足够的受体暴露量,因此研究小组在验证方法或靶点的有效性或无效性方面毫无进展。在II期临床试验被归类为因疗效失败的21%项目(尤其是在神经科学领域),无法确定靶点参与度或药效学活性。在所有这些案例中,由于没有化合物暴露和/或靶点组织药效参与的证据,因此尚不清楚化合物是否对机理假设进行了测试。这些项目被归类为 "无益 "失败,因为它们未能验证或推翻靶点假设,研究小组对其靶点假设的理解没有提高。
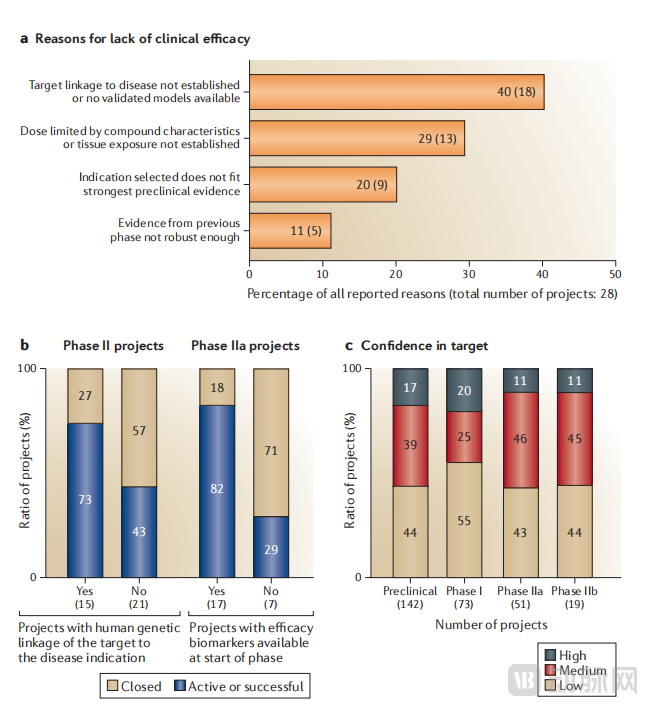
对于那些对靶点验证、靶点与疾病的遗传联系,或对靶点在疾病发病机制中作用的理解更为自信的项目,由于缺乏疗效而失败的可能性较低。73%的具有一定靶点与疾病遗传联系的项目在II期处于活跃或成功状态,而没有此类数据的项目仅有43%。患者选择也是项目成功的一个 影响因素;对患者选择的高度自信与IIb期的活跃项目呈正相关,而对患者选择的低度自信与同一阶段由于缺乏临床疗效而终止的项目呈负相关。
令人惊讶的是,有一些项目(28 个项目中的 9 个)表明,根据当时对疾病的科学理解,他们的开发计划并未瞄准最佳患者人群。为了更好地理解这一点,我们根据科学证据,考察了团队对其在疾病适应症和患者人群方面的靶点的信心水平如何变化,并将其与对感知到的商业价值的信心进行比较。在开发早期,项目团队对研究靶点最合适的适应症和患者人群表现出更大的信心,而对商业价值的信心则较低。相反,在后期阶段,项目组对项目的商业信心很高,但对项目是否符合科学依据最合适的适应症和患者群体的信心却很低。这表明,除了根据当时对疾病的科学理解研究最合适的患者人群外,一些团队还受到商业价值的驱动。
导致项目失败的一个令人惊讶的因素是在没有足够可靠数据的情况下,将项目转入下一阶段。例如,由于缺乏临床疗效,在II期失败的项目中有18%(28个项目中的5个)被认定是在临床证据不足的情况下过渡到这一阶段的,这表明项目管理不够完善。出现这种情况的一个潜在原因可能是,如前所述,使用基于数量的指标,鼓励项目团队和领导小组将项目推进到下一阶段,以实现年度目标。
只有 5%的项目因候选分子不具备必要的药物特性(例如,与药物代谢、药代动力学、 生物利用度等有关的特性)而失败。这与之前的分析结果一致,表明在过去二十年中,由于此类化合物相关原因而导致的失败有所减少。
其余失败的项目被归类为 "战略性 "项目,是由于非技术或非科学原因而决定终止的项目。例如,阿斯利康在研究期间退出了骨关节炎的研发,因此终止了该适应症的多个项目(主要是在进行 GLP 毒理学测试之前)。战略性终止占总项目终止的 7%(7 个项目),在评估期间,有 4 个临床项目因战略性原因而终止。与因安全性或缺乏疗效而导致的失败相比,这一数字远低于已公布的行业整体数字(2008 年至 2010 年期间,II 期项目终止率为 29%;2011 年至 2012 年期间为 16%)。部分原因可能是,我们在分析中努力挖掘 "战略性 "终止项目的根本原因,并经常将其归类为 "安全性 "或 "有效性 "失败。因此,阿斯利康在这两类中的失败比例明显高于已公布的行业指标。不过,需要注意的是,疾病领域重点的反复战略转移也会导致人员流失增加和生产率降低。
总之,这些数据表明,在早期研发的每一个阶段,科学家和临床医生都必须了解疾病生物学、靶点与疾病适应症的关系以及潜在药物在合适患者背景下的作用机制,并对其充满信心。
3
根据分析数据,阿斯利康确定了五个关键的因素,它们是项目成功与否的重要原因。这些因素包括:正确的靶点、正确的组织、正确的安全性、正确的患者以及正确的商业潜力,并将这五个类别称为5个“R”。
正确的靶点
这体现了扎实的生物和疾病知识的重要性。缺乏疗效是临床试验项目失败的最重要原因。很明显,为药物发现项目选择生物靶点是团队要做出的最重要决定之一。如果一个团队针对感兴趣的疾病选择了错误的靶点,再安全、再有效的分子也会失败。鉴于靶点选择的重要性,人们会期望,随着项目在管线阶段的进展,对靶点的信心会不断增强,而这将受到一系列证据的驱动。这可能包括靶点与人类疾病相关的直接证据、动物模型的遗传证据、对靶点和/或疾病病因的生物学基础的了解、对使用动物模型生成的临床前和临床数据的信心、在临床前或临床环境中使用工具化合物生成的数据以及经过验证的疗效生物标志物。
在我们的分析中,对靶点在人类疾病中的生物学作用的高度信心是项目成功的一个预测因素。例如,在候选药物提名之前,就能获得将靶点与疾病联系起来的人类基因数据的项目,在II期仍然活跃的项目中更为常见(在有证据表明靶点与疾病存在基因联系的项目中,73% 的项目在II期仍然活跃或成功完成),而在终止的项目中,缺乏此类数据的情况更为常见(在因疗效而失败的项目中,57% 的项目没有任何基因验证证据)。有没有可用的药效的生物标志物与项目的活跃程度也存在类似的关联;82% 的具有药效生物标志物的项目在 IIa 期处于活跃或成功状态,而没有此类生物标志物的项目比例不到 30%。
除了进行严格的人体验证外,我们对“正确的靶点”的信心还建立在临床前研究中建立的坚实证据基础之上,特别是基于这些研究数据能否成功转化到人类疾病的信心水平。
总之,了解支持靶点选择的生物学和临床证据至关重要,它为指导进一步研究以加强或否定科学假设提供了基础。在我们的分析中发现的一个惊人现象是,对于大多数项目而言,从临床前候选药物的选择到II期的进展中,人们对靶点生物学作用的信心并没有提高。事实上,正如先前提到的,尽管对靶点生物学的了解有限,但仍然有一些项目继续推进。
正确的组织
证明候选药物在靶器官中的暴露和药理活性。除了选择 "正确的靶点 "外,如果能通过在临床前和临床模型中建立适当的药代动力学/药效学(PK/PD)模型,证明候选药物在靶器官中的暴露和足够的药理活性,成功的概率就会增加。在阿斯利康的分析中,这被称为 "正确的组织",包括药代动力学特性、靶点参与和药理活性,以及对药代动力学/药效学(PK/PD)的适当理解,将这些特性与靶器官结合在一起。
阿斯利康的分析表明,只有少数项目直接因药代动力学/药效学(PK/PD)(即候选药物没有所需的药理特性)而失败。然而,项目问卷显示,不到10%的项目对药物具有良好的特性(例如生物利用度、药代动力学/药效学(PK/PD)、制剂等)和良好的药理学终点(例如靶点占据率和药理调节的证据)具有高度的信心。
对辉瑞候选药物研发成功因素的另一项分析(2005-2009 年期间)证实了 "正确的组织 "概念的重要性,该分析表明,最有可能测试作用机制且II期存活可能性更大的候选药物是那些综合理解了三个关键原则的药物:药物在作用部位的暴露性、药物与药理靶点的结合性、药物在作用部位表达出的药理活性。这些原则被称为 "生存的三大支柱"。
正确的安全性
在阿斯利康的分析中,安全性问题是项目终止的最重要原因。因此,建立对特定分子 "正确的安全性 "特征的信心是提高总体成功率的关键。然而,这并不是一个小问题,因为它取决于多种因素,如疾病适应症及其未满足的临床需求。没有所谓的 "绝对药物安全性";在某一适应症中被认为是可接受的安全性特征,在另一适应症中可能是不可接受的。
安全性评估需要同时处理假设驱动成分(例如,与调节靶点相关的预测风险或潜在风险)和无假设成分(例如,观察到的毒理学信号或化合物引起的不良事件)。后者只有在候选药物或先导系列药物进入广泛的临床前或临床试验后才能确定;此外,这些成分可能只在开发后期或上市后阶段才会出现。鉴于并非所有的安全信号都能预测,安全问题成为临床前和临床阶段之间项目终止的主要原因也就不足为奇了。然而,半数以上的项目因安全问题而失败的局面似乎难以为继。
对安全失败的分析表明,失败的原因可分为两大类:一类是未能检测到安全信号,另一类是未能适当评估安全信号的风险。临床前筛选未能检测到安全信号是造成约 40% 安全失败的原因。这些失败突出说明了临床前安全性筛选的局限性,以及继续研发新检测方法以识别安全风险的必要性。
第二类失败更为复杂。在临床开发中失败的项目通常对临床前安全性缺乏信心,且失败的原因通常直接与临床前安全性观察相关。这类失败主要有三个原因。第一个原因是安全性和预测的有效剂量之间的预计暴露量被高估,无法转化为人体剂量增加。第二个原因是安全信号不明确或难以从临床前数据转化到患者身上,例如,大麻素受体(CB1)拮抗剂项目因rimonabant的撤市而终止——这一影响在临床前模型中是无法预测的。第三个原因是团队观察到并考虑到了安全信号,但项目仍在继续,因为有一个理由相信这些信号在该适应症范围内是可以接受和处理的。在这种情况下,14 个有临床前安全信号的项目中有 11 个后来在临床中因安全问题而终止,这表明团队过于乐观,没有对临床前信号给予足够的重视。
阿斯利康还观察到在安全终止原因中存在“疾病领域偏见”。例如,研究发现因为安全原因终止24%的心血管项目是由于心血管安全问题,因为安全性原因终止的24%的中枢神经系统项目是由于中枢神经系统风险,而31%的呼吸系统项目终止是由于肺部安全性性问题。这在一定程度上反映了不同疾病领域之间靶点的相对分布,同时也说明了预测靶点风险-效益特征的困难。这凸显了根据不同治疗领域定制安全评估方案的需求和机会。
行业离能够在临床试验之前预测分子的完整安全特征仍有很长的路要走,因此,至关重要的是,至少要有对有效暴露的强有力的预测,然后可以在临床试验中相对于安全暴露范围来探索这些有效暴露。最后,重要的是要继续开发预测安全性的生物标志物,以提供对潜在风险的早期洞察。
正确的患者
也就是在正确的患者群体中测试药物。在阿斯利康的分析中,对于那些在临床II期失败的项目,人们往往对其是否在正确的患者群体中进行试验信心不足;而那些有明确的患者分层计划的项目则更有可能取得成功。阿斯利康认为,在确定和研究 "正确的患者 "群体方面的信心是另一个关键的成功因素,它不仅影响成功过渡到后期试验的概率,更重要的是影响证明临床获益的能力。
理想情况下,在整个临床开发过程中都可以通过预测性生物标志物来选择患者。这需要充分了解靶点的生物学特征,正如PARP(多腺苷二磷酸核糖聚合酶)抑制剂olaparib的情况一样,其靶点是具有DNA修复缺陷的肿瘤细胞,例如BRCA1和BRCA2基因。在临床前试验中显示,BRCA1或BRCA2缺陷的细胞系对PARP抑制极为敏感。Olaparib在I期试验中显示出令人鼓舞的结果,该试验中利用BRCA1和/或BRCA2的生殖细胞系突变来丰富研究患者。然而,在浆液性卵巢癌的II期研究中并没有根据BRCA1或BRCA2的突变来选择患者(因为最初认为这是一个过于狭窄的患者群体),并且结果是令人失望的。
对于那些对靶点生物学的了解还不够深入,无法根据药物作用机制确定候选生物标志物的情况,另一种方法是基于已知的疾病分层标志物来选择患者。在所有这些例子中,研发计划都受益于(或本来可以受益于)确定适当的临床生物标志物,以便在临床研发中选择 "正确的患者"。为了取得成功,团队应尽早规划和实施患者选择策略,这应成为研发计划不可分割的一部分。
正确的商业潜力
也就是确保科学上可行的项目同时也具备商业化潜力和行业竞争力。阿斯利康在分析中确定的最后一个主题是对项目商业潜力的理解,以及如何利用这种理解来指导项目的开发。 "正确的商业潜力 "一词用来描述对一个项目最终将提供具有临床差异性和商业可行性的产品的信心。
阿斯利康分析发现对于早期组合中的许多项目,对于“正确的商业潜力”这一维度缺乏信心,要么是因为这些项目相对于其他正在开发的药物没有竞争力,要么是因为它们在未满足的临床需求方面没有明确的差异性。在这些情况下,项目是由“以数量为基础”的文化驱动的。
有趣的是,对于处于临床前和 I 期阶段的项目,研究小组对在正确的患者群体中寻找正确的靶点有很高的信心,而对商业潜力的信心却很低。相比之下,随着项目进入 II 期,团队对在正确的患者群体中寻找正确靶点的信心明显下降,而对商业潜力的信心则明显上升。究其原因,主要是由于这些项目被推向了被认为更具商业潜力的适应症,但这些适应症的科学和医学基础却很薄弱。这些项目中有3/4在开发后期因疗效问题而失败。
最终,"正确的商业潜力 "强调了提供差异化药物的必要性。它涵盖了许多重要因素,包括基于未满足的临床需求的市场机会、患者群体的规模和地理分布、竞争地位、支付环境、达到特定决策点的成本、为差异化和可报销药品向监管部门提交档案的成本、上市时间,当然还有整体计划的风险以及通过FDA的概率。对这些因素的评估需要公司的商业和科学团队之间进行明确的沟通,而沟通必须始终以科学理解和临床需求为基础。
正确的文化
“正确的文化”提倡追求真理而非追求临床进度的行为。通过回顾和分析,我们发现导致产品管线成果不佳的一个重要原因是,团队行为和决策的鼓励和奖励是基于靶点的数量。正如前面所讨论的,许多公司的研究目标都集中在数量上,比如候选药物数量或已进入临床试验的IND药物数量。在实践中,这导致项目更加注重候选药物阶段性成果的实现,而不太关注对靶点生物学的理解、疾病的病理生理学、正确的患者群体以及对如何开发一种差异化(最终可商业化)药物的清晰认识。
在分析中,还可以从选择备选药物的策略中看到“以数量为基础”策略的影响。通常,后备分子是为生物可信度较高的重要项目开发的,其结构应具有多样性,以减轻临床前或早期开发中与化合物相关的问题给项目带来的风险,并且/或者具有与先导分子相比的某些实质性优势。如果使用得当,这种策略可以节省时间,保持项目的势头。然而,由于研究机构会根据候选药物的数量对科学家进行奖励,我们发现有些项目的后备分子在结构上并不多样,也没有比先导分子有实质性的改进。虽然所有后备候选药物都符合进入临床试验的化学标准,研究团队也被认为达到了基于数量的目标,但这些分子并没有为降低项目风险或提高项目成功率做出贡献。因此,一个“化合物家族”中的所有后备候选化合物最终都可能因为与先导化合物相同的原因而失败,而且实际上成功的概率并不比最初的先导分子高。
在一个极端的案例中,阿斯利康发现一个项目的化合物家族中有七个后备分子,它们都被认为是成功交付的候选化合物,但却都因相同的临床前毒理学发现而失败。
这种情况导致项目组合中备用候选药物的数量过高。在撰写这份报告时,阿斯利康的管线产品组合中约有50%是后备分子。
4
自那时起,阿斯利康进行了相当大的改革,以汲取经验教训,并将“5R”作为其项目框架和运营模式的核心部分。“这意味着我们有意识地从以前在研发中使用的以高产量为基础的战略,转变为注重项目质量和理解深度的战略,将其作为成功的关键驱动力。”论文中强调。
采用“5R”框架直接导致研究和早期开发项目组合的规模和形态大幅缩减。对于剩余的项目或即将启动的项目,每个项目团队都需要清楚地表达对“5R”框架各个组成部分的信心,识别知识理解方面的差距,并在项目实施期间努力弥补这些差距。这反过来又提高了项目优势和风险方面的决策水平和透明度。
除了采用该框架外,阿斯利康也对某些关键能力进行了实质性投资。例如,建立个性化医疗保健和生物标志物支持的能力,以帮助确定和提供“正确的患者”维度的数据。因此,现在85%的项目都包括个性化医疗保健战略,而且我们的初步分析表明,具有前瞻性个性化医疗保健方法(例如辅助诊断)的项目取得成功的可能性要高出四倍(数据未显示)。此外,阿斯利康已实现基于模型的药品发现平台,使用最先进的建模和仿真方法,更好地理解和预测分子的药代动力学/药效学( PK/PD) 特性,不仅增强我们对“正确的组织”维度的理解,也增强我们对“正确的靶点”和“正确的安全性”的理解。最后,通过建立支付者与医疗相关的数据库,提高了我们对支付者和报销情况的理解,从而改善了我们对5R框架中“正确的商业潜力”的认识。
归根结底,5R 框架并不是要在每个方面都有十足的把握;但是,通过使用这一框架,团队可以确定开发过程中需要解决的关键风险领域。他们可以对项目进行更客观的评估,并与管理机构进行更透明的讨论。5R抓住了在项目中可能被认为是关键技术方面的问题,并有助于支持团队在正确阶段做出最佳决策。然而,团队也需要在 "正确的文化 "中工作。确保团队在提出 "关键问题 "时得到鼓励和奖励、科学质量得到认可、与外部科学界保持良好的联系,并得到经验丰富、具有良好判断力的领导者的支持,这一点至关重要。
阿斯利康在与项目团队进行的访谈中,一个潜在的主题贯穿始终,那就是,保持管线组合规模的必要性导致了个人和团队的奖励与项目进度联系在一起,而不是与“追求真理”的行为联系在一起。但项目团队中的科学家和临床医生需要相信,他们的个人成功和职业发展与项目进度本质上不相关,而与科学质量、明智的风险承担和良好的决策有关。
参考文献:David Cook 1, Dearg Brown 1, Robert Alexander, et al. Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework. Nat Rev Drug Discov. 2014 Jun;





























