AI在药物研发领域的应用正以星火燎原之势迅速发展,小分子药物开发则是与AI技术交融最深的细分领域之一。
DNA编码化合库(DEL)是近年新兴的小分子药物筛选技术之一,在新药发现中正得到越来越多的应用。这一技术利用具有特定序列的DNA片段对所有参与构筑的分子砌块与骨架进行编码,之后化合物不断排列组合,在得到新的化合物,如此反复,可快速产生数以百万甚至亿计可识别的化合物分子。在此基础上建立一套“信息-结构-功能”的数据系统,可以以较低的成本快速探索巨大的化学空间。
基于此,DEL技术被认为可以帮助药企找到成药性高的新颖分子,也受到了越来越多AI制药领域企业的关注。比如药明康德推出了DELopen和DELlight平台,康龙化成、药石科技也布局了DEL领域。
值得注意的是,AI制药的前提是有庞大的化合物数据库,DEL技术正好提供了海量的化学结构。因此,结合DEL技术和AI技术,或将为AI制药带来新的惊喜。
小分子药物发现公司Anagenex正是利用这一思路,将DEL技术与机器学习(ML)相结合,以实现廉价、快速地为每种疾病找到候选药物的愿景。他们的目标是通过基于组合化学、机器学习和快速大规模迭代的方法,从根本上加速传统的药物发现过程,通过坚实的数据基础融合大规模实验数据收集和机器学习,使药物发现更快、更高效。
在创立Angenex 之前,Nicolas Tilmans的大部分职业生涯都在实验室和计算机科学之间交替度过。
在攻读博士学位之前,他在斯坦福大学学习生物化学和计算机科学专业。期间,Nicolas参与开发了DNA编码化合库技术 (DEL),可以将早期药物发现的通量提高1,000倍。毕业后,Nicolas曾在工业界担任数据科学家,最终成为一家患者数据机器学习公司的工程副总裁。
基于多年在计算科学和实验化学领域的积累和思考,Nicolas希望打破计算科学与实验科学之间的界限,为后来创立Angenex埋下了伏笔。2019年,Anagenex成立,Nicolas Tilmans担任公司CEO。
2022年,公司邀请Ryan Kruger加入团队担任首席科学官。Ryan在制药和生物技术领域拥有18年的经验,其中包括在GSK任职的15年,Ryan担任了肿瘤学研发部门的癌症表观遗传学研究部门副总裁,参与发现和开发行业领先的表观遗传学资产。
在GSK任职期间,Ryan领导的研究部门推出了六种新型小分子疗法,涵盖了从发现到 IND 申请,再到临床开发的全过程。 Ryan在生物化学方面的学术背景加上他的行业经验使他能够确定最有希望的治疗靶点,并加速候选药物进入临床开发,以帮助有需要的患者。
此外,公司的早期发现高级副总裁Joe Franklin是DNA编码库化学领域富有成就的领导者,拥有15年的领导和在DEL团队工作的经验。他的创业动力和DEL领域的多年经验积累也使Anagenex成为生物技术领域极具创新性的DEL团队。
基于公司的核心理念和团队能力,Anagenex于2022年6月宣布完成3000万美元A轮融资。据悉,该轮融资资金用于扩大公司创新开发的数据生成平台,并通过该平台开发一系列的项目管线,以解决富有挑战性的未被满足医疗需求。
Nicolas Tilmans认为,在美国FDA批准的药物名单中,小分子药物始终占据大多数,也证明了小分子药物不可取代的重要地位。对于大多数病人来说,小分子药物仍然是最好的、最具成本效益的药物。然而,当前小分子药物的开发仍然非常具有挑战性。
在很长一段时间里,生物学研究中实验方法是起主导地位的。随着生物体系研究尺度越来越复杂,生物研究对计算方法的依赖越来越强,未来“干湿结合”,即计算和实验相结合将成为生物学研究趋势,从而解决更多生物问题特别是药物设计问题。
Angenex将极高通量的生物化学与机器学习相结合加速药物发现,以发现治疗疑难疾病的新疗法。“我们相信,结合DEL的高通量化合物库,以及ML处理大量数据的核心优势,能在同类AI制药企业当中脱颖而出,找到更快、更可靠的识别新化学物质的方法。” Nicolas表示。
DEL技术能够提供海量的化学物,机器学习可以超越DEL化合物的局限性,通过创建一个完全集成的计算实验和湿实验室平台,干湿结合相互反馈,有助于找到具有更多难治疾病的目标化合物,并通过有效地优化这些分子,使其成为在临床上成功的药物。
“我们专注于如何运用计算软件平台满足实验室需求,并使研究过程更高效、更有成果、更愉快。实验室和计算科学可以成为真正的合作伙伴,相互信任,并使彼此变得更强大。” Nicolas表示。
传统的药物发现的过程通常是漫长且投入巨大的。从发现致疾蛋白质的那一刻起,患者获得药物通常需要25年的时间。这个过程太慢,病人没有时间等待。
AI技术的飞速发展为药物发现带来了新的惊喜,但要真正实现落地还面临诸多障碍。其中AI指导药物发现的一大挑战便是数据问题,当前数据量太小,不足以支撑人工智能的持续学习和迭代。
受到进化论的启发,Anagenex通过建立闭环迭代系统,在大规模实验室实验和下一代机器学习驱动的预测之间形成交替循环,带动更高质量的数据生成,指导小分子药物发现,从而实现更快更好地向患者提供新型小分子药物。
Anagenex凭借新型ML定向进化平台,将大规模数据生成与机器学习相结合,赋能小分子药物发现。该平台以闭环迭代系统,对多达数十亿定制合成的化合物进行并行评估,以产生大规模高质量数据集,指导下一代小分子药物发现。
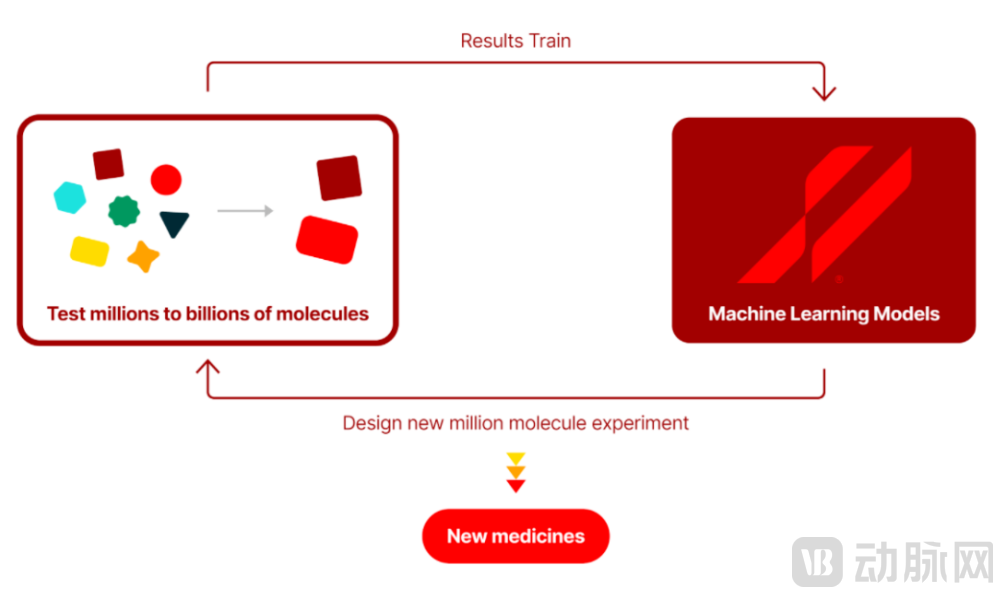
首先,公司利用DNA编码库(DEL)和亲和质谱技术(ASMS),对数十亿个化合物进行平行实验测试,并从中筛选出在某些疾病中可能存在调节作用的重要蛋白质“靶点”。对于任何选定的靶点,公司都会在十亿个化合物规模层面进行数十次实验,生成丰富、高质量的数据集。
接下来,这些测量结果将被输入到专有的机器学习(ML)算法中进行学习,设计新的百亿化合物实验。同时,该算法不仅考虑了实验结果,还考虑了来自内部数据库的数千亿个其他数据点。也就是说,ML模型可以根据数据循环结果设计出下一代经反复训练之后"进化"的化合物。
最后,设计出的化合物将由Anagenex进行合成和测试。以上三步形成了以真实数据来完善ML模型的良性循环,其中每一个循环都会推动产生更好的数据,不断迭代并改进人工智能预测结果,推动药物发现过程更快,效率更高,可更快地找到更多小分子药物,为患者提供更多治疗药物选择。
据了解,Anagenex已经建立了一个定制的平行生物化学实验室,将上述过程中的每个步骤都小型化、自动化。这意味着Anagenex可以快速生成高质量数据,利用ML算法,Anagenex对化学空间有了前所未有的清晰视野。据悉,目前Anagenex 正在开发多个高价值靶点,覆盖肿瘤学、炎症性疾病、肌肉骨骼疾病和心血管医学等多个领域。
将机器学习与大规模生化工具相结合,Anagenex实现了更有效、高通量的化合物分析方式。Angenex的技术有望打造高效的药物发现管道,为众多疾病领域带来有益影响。
随着新化学方法与新计算工具的不断深入结合,为了干湿结合将成为药物研发常态,而Anagenex正引领着新一代小分子药物发现走向变革。





























