2023年12月8日,FDA批准了首个CRISPR基因编辑疗法Casgevy上市,用于治疗治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病(SCD)患者。该疗法最初由CRISPR Therapeutics于2018年启动,此后与Vertex Pharmaceuticals合作推进。
过去十年,CRISPR基因编辑技术催生了无数基因编辑公司、吸引了数十亿美元的投资、成就科学家拿下诺贝尔奖,并最终在今年迎来全球第一个获批的CRISPR基因编辑药物Casgevy(exa-cel)。Casgevy的获批上市,让围绕在CRISPR-Cas9的专利也不得不再次被关注。
几天后,Vertex Pharmaceuticals宣布将向张锋创立的基因编辑疗法开发公司Editas Medicines支付1亿美元,外加潜在许可费,以获取其CRISPR-Cas9基因编辑技术的非独家授权,用于包括Casgevy在内的针对镰状细胞病和β-地中海贫血的BCL11A基因的体外基因编辑药物。
据悉,Editas将收到来自Vertex的5000万美元预付款,还有资格通过或有支付获得另外5000万美元,但双方没有透露触发这笔5000万美元或有支付的条件。此外,Editas还有机会在2034年专利到期之前,每年获得1000-4000万美元的专利许可费。
Casgevy的批准之旅是一个关于科学发现、大胆下注和咬定青山不放松的故事。RNAi治疗领域的先驱Alnylam Pharmaceuticals,用了16年时间才将一项学术发现转化为第一款RNAi药物。相比之下,Casgevy的首次批准是在科学发现11年、CRISPR Therapeutics成立10年后。
2012-2015:豪强入场,掀起狂热技术竞赛
1987年,来自日本的石野纯良教授首次在大肠杆菌中发现了CRISPR序列的存在。同一时期,来自地中海的Francisco也在一种古细菌中发现了CRISPR的存在,并坚定地认为,CRISPR可能存在某些特殊的功能。不过当时研究人员并不清楚CRISPR具有哪些功能。
2012年8月,Emmanuelle Charpentier,Jennifer A. Doudna及Michael Hauer共同通讯在 Science 在线发表题为“ A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity”的研究论文,宣告这一在生命科学领域和医学领域掀起基因编辑革命浪潮的CRISPR-Cas基因编辑技术横空出世。属于CRISPR基因编辑的历史就从此开始。
这篇论文的最后一句暗示了即将到来的科学革命:一个古老的细菌防御系统可以被改造以提供“considerable potential for gene targeting and genome editing applications.”
在距离CRISPR被证明具有基因编辑功能不到一年的时间里,科学家、投资者和创业者们开始制定商业计划,建立新的基因编辑公司,着手将该项技术用于遗传疾病的治疗,并在随后的几年时间中,将应用范围拓展到癌症、艾滋病、慢性疼痛、莱姆病等多个治疗领域。
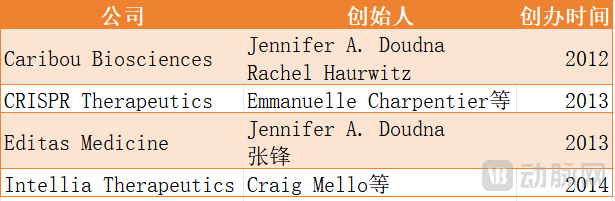 部分基因编辑公司 动脉网制图
部分基因编辑公司 动脉网制图
到目前为止,Caribou Biosciences(驯鹿生物)、CRISPR Therapeutics、Editas Medicine和Intellia Therapeutics都已成功在纳斯达克敲钟上市。
2014年,CRISPR Therapeutics完成A轮2500万美元融资,这一轮的投资方为Versant Ventures。“创办一家基因编辑公司相当复杂,崭新的技术、专家、投资方以及复杂的知识产权环境等。所以一开始我们只接触了两个VC:Versant Ventures和Atlas Ventures。”CRISPR THERAPEUTICS联合创始人Shaun Foy说。
后来,由于两家VC对公司的设想和愿景不一致,Versant Ventures以更高的投资金额赢下了这场竞赛。转头,Atlas Ventures便联合诺华共同出资1500万美元投资创办了另一家基因编辑公司Intellia Therapeutics。
“到2014年底,有10个投资者纷至沓来。当时,我真的认为CRISPR应当是一家涵盖所有技术、专利产业以及科学家的公司,但很明显的是,所有人都因CRISPR这一技术狂热,以致于所有的公司都集中于这一件事。现在来看,也许让更多家公司共同来做对患者更好,很难想象一家公司如何能高效完成所有的环节。”Shaun Foy表示。
2014 - 2016:百舸争流,确定技术路线
数以千计的人类疾病都由基因突变引起。从理论上将,被称为“上帝的手术刀”的CRISPR能够解决几乎所有问题。
Editas Medicine是基因编辑领域第一家上市的 CRISPR 基因编辑公司。旗下共有 9 条在研管线,包括体内基因编辑疗法、体外基因疗法以及细胞治疗项目。其中,基因编辑治疗进展更快,均有管线进入临床研究阶段;针对癌症的细胞治疗项目进展略慢,处于临床前研究阶段。
Editas Medicine的EDIT-301是一种在研的细胞疗法,用于治疗SCD和TDT。EDIT-301由来自患者的CD34+造血干细胞和祖细胞构成,这些细胞在γ珠蛋白基因(HBG1和HBG2)启动子处被具高度特异性、效率性的工程化AsCas12a核酸酶编辑。源自EDIT-301 CD34+细胞的红细胞表现出持续增加的胎儿血红蛋白生产,这可能为严重SCD和TDT患者提供一次性、持久的治疗效果。
不久前,Editas Medicine在ASH年会公布EDIT-301的最新试验结果,结果显示,在RUBY试验中,所有患者均未发生血管闭塞事件(VOE)。在EdiTHAL试验中,所有患者的总血红蛋白均早期稳健升高,高于输血非依赖性阈值9 g/dL(n=6)。
Intellia同样针对在Ex Vivo(体外)与In Vivo(体内)基因治疗开发出专有的革命性产品。Intellia的首发管线、全球首款体内CRISPR基因编辑疗法NTLA-2001,采用LNP肝脏递送系统,携带靶向人TTR基因的sgRNA和经过优化的化脓性链球菌Cas9蛋白的mRNA序列。今年10月,NTLA-2001已被FDA批准开展关键三期临床,治疗甲状腺素转运蛋白淀粉样变(ATTR)。
对于刚起步的biotech来说,选择适应症需要考虑多种因素。“最初,为了消除技术风险,我们将重点放在Ex Vivo(体外)和基因敲除策略上,寻找高度未被满足需求的疾病和通过编辑少量细胞可产生重大影响的疾病的交集。最为关注的两种路线是敲除HIV中的CCR5和敲除BCL11A,甚至与吉利德就敲除CCR5的想法进行了初步对话。”Shaun Foy说。
“后来我们聘请了咨询公司,大概收到了20个不用适应症的提案。不过最终我们没有选择其中的一个。”CRISPR Therapeutics联合创始人兼CEO RODGER NOVAK说。
CRISPR Therapeutics最终选择的适应症是SCD和TDT。在CRISPR技术被证明具有基因编辑功能之前,Stuart Orkin便发现了基因BCL11A,为这两种疾病的治疗提供了技术路线。
但彼时CRISPR技术仅有一篇 Science 做背书,“定位基因编辑的位置是最大的挑战。为此,我们做了太多大型试验,研究不同的可能性,针对不同的特性进行优化。还需要考虑各种问题,使用什么指南?制作合成指南吗?是否要转录?需要加入核苷酸吗?如何将其引入细胞?”CRISPR Therapeutics首席科学研究员BILL LUNDBERG表示。
在推进exa-cel的研究进程中,CRISPR Therapeutics完全相信,CRISPR技术能够治疗SCD和TDT,只是需要彻底研究工程路线。
2015-2019:CRISPR的“失控时刻”
2014年,美国专利商标局将CRISPR/Cas9技术相关的第一个专利授予了MIT的张锋团队,引起了巨大争议,Emmanuelle Charpentier和Jennifer A. Doudna认为自己先发现了CRISPR-Cas9,而且更早申请专利,而张锋他们在动物细胞中的成功只是她们工作的延展。
之后几年,背靠加州大学伯克利分校Emmanuelle Charpentier和Jennifer A. Doudna和MIT的张锋团队和哈佛大学布罗德研究所(Broad Institute of MIT and Harvard)之间就谁发明了这项技术开始了激烈的专利争夺战。该专利战分为两个阵营:CRISPR Therapeutics和Intellia与Berkeley结盟,Editas与Broad结盟。
2012年8月,Emmanuelle Charpentier和Jennifer A. Doudna领导的团队发表了CRISPR-Cas9可以切割DNA的论文。2013年1月,张锋团队和哈佛大学的George Church团队同时发表了改进后的CRISPR-Cas9基因编辑技术可以在老鼠和人体细胞中工作的研究论文。Emmanuelle Charpentier和Jennifer A. Doudna领导的团队将CRISPR-Cas9基因编辑技术应用于哺乳动物的研究则晚了几周发表。
2013年,张锋和Jennifer A. Doudna等人合伙创建基因编辑公司——Editas Medicine,随着专利争夺战发生、谈判破裂,也由此诞生了另一家传奇的基因编辑公司Intellia Therapeutics。
2022年,延续数年的的基因编辑技术专利之争终于等来了美国专利商标局(USPTO)的裁决,博德研究所(Broad Institute)的张锋团队仍然拥有在真核细胞中使用CRISPR/Cas9技术的专利,Emmanuelle Charpentier和Jennifer A. Doudna则失去了在最为关键的领域应用的专利优先权。
专利只是其中一个问题,而有关基因编辑的伦理道德也是企业IPO后面临的一大难题。
2017年,由CRISPR基因编辑带来的生物恐怖主义担忧开始出现。Jennifer Doudna和Samuel H Sternberg合著的《造物之隙:基因编辑与不可思议的演化控制》中,Doudna担心人种改良学卷土重来,“或许我们只能在“细胞体”上进行基因编辑:改变那些无法传给下一代的受影响组织中的基因?或者是“种系”编辑,以能够传给后代的方式改变早期胚胎?尽管这不免让人想起人种改良的黑暗时代,事实上却是修复大多数“疾病基因”的唯一方式。但如果真的这么做了,我们是应该只修复像镰形细胞贫血症这样会损害后代的基因呢?还是也可以改变那些可能致病的基因呢——比如能够引起高胆固醇和心脏疾病的基因?”
2018年,南方科技大学副教授贺建奎和他的团队对外宣布:经艾滋免疫基因编辑的双胞胎几周前已经出生。这一消息更是引发巨大舆论漩涡。
关于基因编辑的道德伦理问题,早在1999年,欧洲《人权与生物医学公约》便已经明确禁止可遗传的人类基因修改。这是迄今为止人类基因技术方面最权威的国际文件。
2016-2021:携手,为了走得更远
投资人并不是唯一看到CRISPR价值的人,大型制药公司也开始陆续进场。拜耳、Vertex、再生元制药和诺华是在基因编辑领域布局最多的MNC代表。
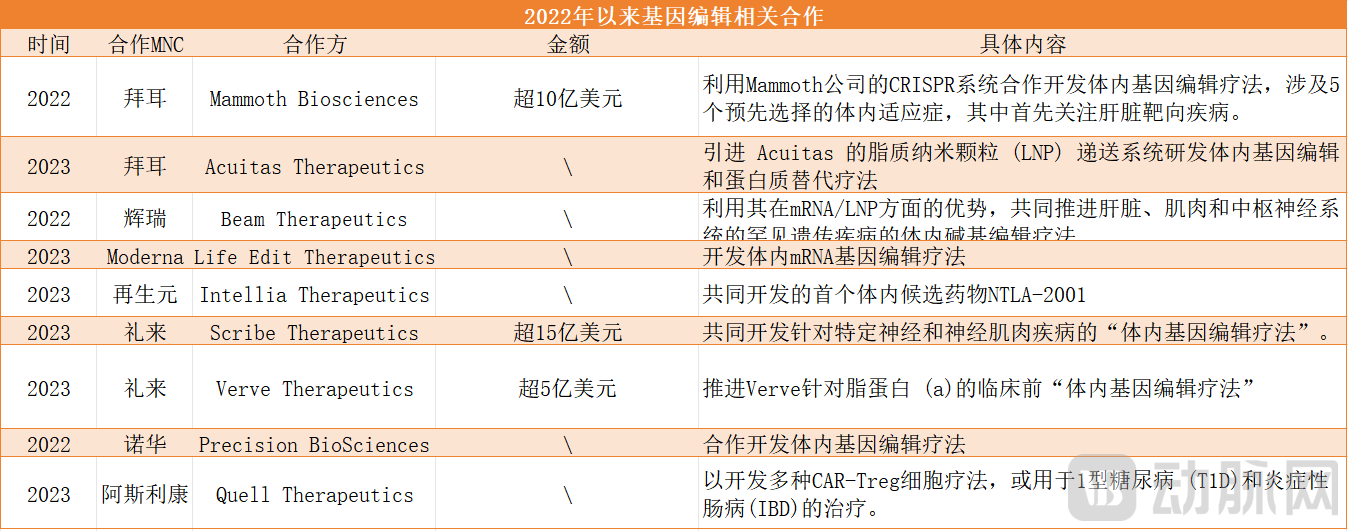 2022年以来基因编辑相关合作 不完全统计
2022年以来基因编辑相关合作 不完全统计
而CRISPR Pharmaceuticals与Vertex的合作则始于2015年。2015年,Vertex与CRISPR Pharmaceuticals公司达成合作,共同打造血红蛋白病基因疗法。两年后,Vertex与CRISPR Pharmaceuticals宣布联合开发CTX001(exa-cel)。
2021年4月,Vertex宣布,更新与CRISPR Therapeutics关于在研疗法CTX001(exa-cel)的合作条款。根据修订后的协议,Vertex将领导exa-cel的全球开发、生产和推广,CRISPR将获得9亿美元预付款,在exa-cel获得首次监管批准后,可能获得2亿美元的里程碑付款。
2019-2023:更多的试验结果和更多的受益者
2019年,CRISPR Therapeutics和Vertex用Casgevy治疗了首例β地中海贫血患者。不久之后,他们治疗了第一位镰状细胞患者。
“我们给第一位患者给药时,如坐针毡,试图弄清楚他们的胎儿血红蛋白会有多高,以及Casgevy是否会转化为临床益处。”SARAH CANNON 研究所血液学家HAYDAR FRANGOUL说。好在结果不错,第一位接受治疗的患者得到了明显改善。
经过四年的测试,Casgevy的好处是显而易见的。这种治疗可以消除镰状细胞患者经常经历的疼痛危机,也是的患有严重β地中海贫血的人可能不再需要定期输血。
2023年11月,exa-cel获得英国药品和健康产品管理局的有条件上市许可,成为全世界首款获批上市的CRISPR基因编辑疗法。12月,FDA批准了Casgevy(exa-cel)上市,用于治疗 12 岁及以上患有复发性血管闭塞危象 (VOC) 的镰状细胞病 (SCD) 患者,预计明年将对适应症地中海贫血(TDT)做出决定。
继英国、FDA批准后,Casgevy(exa-cel)正在谋求欧洲获批。12月15日,欧洲监管机构发布该药物的积极意见,该决定最晚于明年2月做出。同样,与在英国相似,Casgevy在欧洲的潜在许可也将是“有条件的”,要求Vertex 和 CRISPR在2026年8月前提交正在进行的关键试验结果和长期随访数据,以评估长期效果和安全性。
至获批FDA后,Casgevy(exa-cel)顶着“第一个CRISPR基因编辑药物”的前缀迎来了自己的高光时刻。




























