2021年9月,生物技术公司Lycia Therapeutics(以下简称Lycia)获得7000万美元B轮融资,由Redmile Group领头,Alexandria Venture Investments、Invus、Versant Ventures等参与跟投。融资金额主要被用于研发溶酶体靶向嵌合体(LYTAC)蛋白降解技术。
LYTAC技术突破了传统靶向蛋白降解技术仅靶向胞内蛋白的局限性,能够有效实现胞外蛋白和膜蛋白的降解,从而扩展治疗靶点,实现更多疾病的治疗。
作为最早推动LYTAC技术临床转化的公司,Lycia究竟有何过人之处?本文将从团队资源、技术特色、发展概况三个方面进行介绍。
Lycia成立于2019年,总部位于美国加利福尼亚州圣地亚哥,专注于未开发的细胞外蛋白质组,目前正利用其LYTAC平台发现和开发可降解细胞外和膜蛋白的新型疗法,从而解决一系列难以治疗的疾病,包括癌症和自身免疫性疾病。
2019年,在位于圣地亚哥的Inception实验室内,Lycia由医疗保健风险投资公司Versant Ventures与Carolyn Bertozzi博士合作创立。
Versant Ventures成立于1999年,是一家致力于帮助杰出企业家建立下一代公司的医疗保健风险投资公司。Versant主要对以研发新型疗法为主的企业,进行针对性投资。Versant组建了一支拥有深厚投资、运营和科学专业知识的团队,能够以实际操作的方式进行公司建设。自成立以来,已有超过75家Versant投资的公司成功实现了IPO或被收购。有了Versant这个大靠山,Lycia在融资、运营、专家团队等方面拥有足够的底气。

Carolyn Bertozzi博士是斯坦福大学化学与科学学院贝克家族院长以及霍华德·休斯医学研究所(HHMI)的研究员,33岁就斩获“麦克阿瑟天才奖”。该奖被视为美国跨领域最高奖项之一,旨在表彰在社会发展中发挥重要作用的创造性人才。同时Carolyn Bertozzi博士也是Lycia的学术创始人。2020年7月,Bertozzi课题组在Nature杂志上发表了突破性研究,首次提出了LYTAC的概念。他们证实,可以利用一种不依赖阳离子的溶酶体靶向受体(CI-M6PR)来捕获细胞外蛋白,并将其运输到细胞内的溶酶体中进行降解。

Carolyn Bertozzi博士(图源:斯坦福大学官网)
基于Carolyn Bertozzi博士的研究成果,Lycia将发展目标定位为开发利用LYTAC蛋白降解技术。目前Carolyn Bertozzi博士是Lycia科学顾问委员会的主席,对于Lycia的技术研发起着至关重要的作用。
除了Carolyn Bertozzi博士,Lycia还拥有众多领先的科学家。例如于2013年获得诺贝尔生理学或医学奖的Randy Schekman博士;斯坦福大学免疫学、移植和感染研究所(ITI)主任Mark M. Davis博士;俄勒冈健康与科学大学奈特癌症研究所所长Brian Druker博士等。
一家优秀的生物技术公司,除了需要卓越的生物医药人才,还需要一个好的领导。2020年4月,Aetna Wun Trombley上任Lycia的CEO。在加入Lycia前,她曾在生物制药公司NGM Biopharmaceuticals(NASDAQ:NGM)历任业务发展主管、首席运营官、总裁兼首席运营官。更早之前曾担任过诺华的战略助理、麦肯锡的业务经理。
多数疾病的产生和发展都与蛋白的异常表达或聚集有关。针对该类病理机制,传统的药物研发思路是开发各类小分子或蛋白类的抑制剂,通过占据和阻断靶标蛋白的活性作用位点,抑制蛋白的功能活性。此类研发策略需要靶标蛋白具有明确的“可成药性”的活性口袋或结合位点,然而大约80%的蛋白质不具备上述活性结合区域,因此被认为是”不可成药”的。
近几年,以蛋白水解靶向嵌合体(PROTAC)为代表的蛋白降解剂为靶向这些传统上被认为是不可成药的蛋白带来了新的机会。但PROTAC技术只能降解细胞内的蛋白,而很多治疗靶点(如生长因子、疾病相关受体、细胞因子)其实属于胞外蛋白和膜相关蛋白,这两类蛋白占人类蛋白质组的40%。
如果能解决这部分蛋白的降解,相关疾病的治疗将得到极大的改善。为此,Carolyn Bertozzi博士及其团队研究出了LYTAC技术,利用内吞-溶酶体途径,通过靶向蛋白的胞外结构域,实现了胞外蛋白和膜蛋白的靶向降解,扩展了治疗靶点。
LYTAC是一种双功能分子,主要由两个结合域组成,一端是低聚糖肽(oligoglycopeptide)基团,另一端是靶向靶蛋白的抗体、多肽或小分子,这两个结合域通过一个化学链连接起来。
第一代LYTAC:M6P-LYTAC
2020年7月,Bertozzi课题组在Nature上首次提出LYTAC概念。初代LYTAC利用的溶酶体靶向受体是CI-M6PR(cation-independentmannose-6-phosphate receptor),对应的配体是M6P(mannose-6-phosphonate)。
M6P-LYTAC技术的工作原理如下:
首先,LYTAC分子的靶蛋白配体部分与靶蛋白的胞外结构域结合,同时寡糖结构与CI-M6PR结合,从而产生CI-M6PR-LYTAC-靶蛋白复合物。
然后,该复合物会被细胞膜“吞没”,形成一个运输囊泡。
最后,囊泡会将复合物运输到溶酶体中(一种含有蛋白质降解酶的细胞器),之后靶蛋白被降解,受体进入循环再利用。
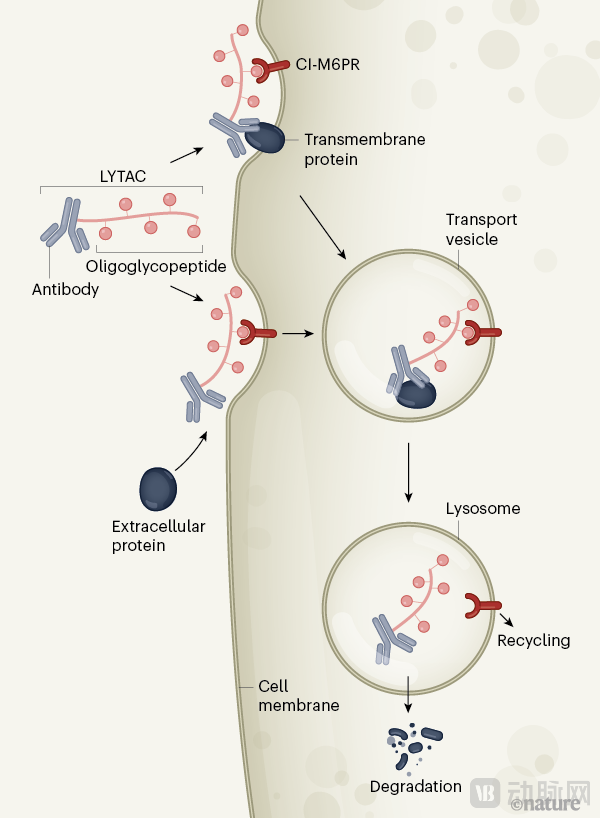
M6P-LYTAC工作原理(图源:Nature)
该课题组利用M6P-LYTAC成功降解了胞外蛋白(载脂蛋白E4)和多种膜蛋白,包括表皮生长因子受体(EGFR)和转铁蛋白受体1(CD71)、程序死亡蛋白配体1(PD-L1),证明了LYTAC平台的适用性。
第二代LYTAC:GalNAc-LYTAC
考虑到CI-M6PR在多种细胞中广泛表达,这种广谱活性的LYTAC安全性尚不清楚。因此,Bertozzi课题组进一步探索了其他溶酶体靶向受体的可能性,希望找到表达有组织或细胞类型限制的受体,用于开发LYTAC。
最终Bertozzi课题组采用了溶酶体靶向受体ASGPR(asialoglycoprotein receptor),对应的配体是GalNAc(N-acetylgalactosamine)。相关研究成果在2021年3月被发表在了Nature Chemical Biology杂志上。
Bertozzi课题组开发了与ASGPR结合的LYTAC,即GalNAc-LYTAC。由于ASGPR是一种肝脏特异性溶酶体靶向受体,因此GalNAc-LYTAC能够以限制细胞类型的方式降解胞外蛋白。
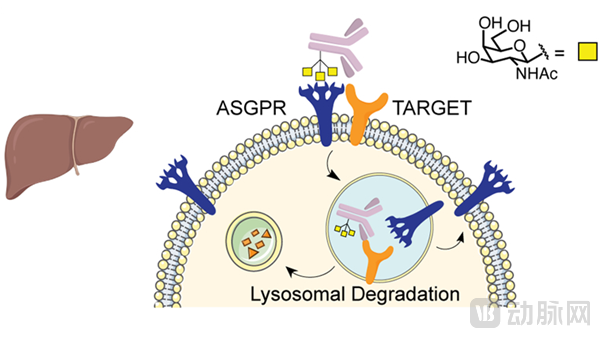
GalNAc-LYTAC(图源:Nature Chemical Biology)
LYTAC技术弥补了之前PROTAC等蛋白质降解技术仅可降解胞内蛋白结构域的局限性,实现了胞外蛋白与膜蛋白的降解,极大地拓宽了靶向蛋白质降解技术的应用空间。
Lycia以研发LYTAC疗法为重点,推动LYTAC技术临床转化,具有足够的创新性和广阔的市场前景。
Lycia表示,在成立的早期,将专注于癌症和自身免疫性疾病。Lycia将主要研发三大类药物:靶向跨膜蛋白的分子,可以清除蛋白聚集体或致病性免疫复合物的分子,以及可以降解驱动自身免疫的循环抗体的分子。
通过Inception实验团队,Lycia进行了验证性研究,结果表明,细胞表面蛋白(如EGFR、PD-L1)以及分泌蛋白(如ApoE4)均能通过这种技术进行降解。因此,LYTAC蛋白降解技术有望治疗多种疾病。过去难以有效针对的受体酪氨酸激酶,或是致病的免疫复合体,也有望通过这一技术进行降解。
此外,Lycia还计划利用LYTAC研发被更多人接受的基因疗法。
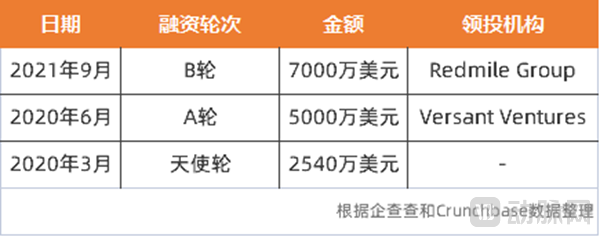
Lycia成立不到3年,就获得了3笔融资,融资总额超1.4亿美元,得到了资本的高度青睐。
除了获得巨额融资外,Lycia也获得了和制药巨头礼来(Lilly)合作的机会。2021年8月,Lycia与礼来(Lilly)达成战略合作协议,双方计划使用Lycia专有的LYTAC蛋白降解技术发现、开发和商业化靶向创新靶点的蛋白降解疗法,重点疾病领域包括免疫和疼痛。根据协议条款,Lycia将获得3500万美元的预付款,此外还有资格获得超过16亿美元的潜在里程碑付款以及未来的销售分成。通过此次合作,两家公司将利用LYTAC平台开发多达5种蛋白质降解剂。
Lycia作为最早推动LYTAC技术临床转化的公司,不仅有风投公司Versant和LYTAC技术首创者Carolyn Bertozzi博士作为靠山,还和制药巨头礼来结成合作伙伴关系,有望成为第一家研发出LYTAC候选药物的公司,乃至第一家推动LYTAC产品上市的公司。让我们期待那一天的到来。





























